결합의 극성과 분자의 극성
결합의 극성과 분자의 극성을 구별하라.
---------------------------------------------------
▶ 참고: 제8장 화학 결합의 기본 개념. 목차
[ https://ywpop.tistory.com/15249 ]
---------------------------------------------------
서로 다른 원자 사이의 공유결합은 극성 공유결합입니다.
( 단, 유기 화합물에서 C–H 결합은 예외. )
극성 공유결합의 정도는 쌍극자 모멘트로 정량화할 수 있습니다.
그런데 쌍극자 모멘트는 스칼라량이 아닌
크기와 방향을 둘 다 가지는 ‘벡터량’입니다.
이 때문에 분자 내에 극성 공유결합이 존재하더라도,
그 분자는 극성 분자일수도 있고, 아닐 수도 있습니다.
예를 들어, 이산화탄소, CO2의 경우,
C=O 결합은 극성 공유결합입니다.
그러나 이산화탄소 분자의 기하 구조는 직선형이므로,
O=C=O
탄소를 중심으로 180도 양쪽에 산소가 자리 잡고 있어서
C=O 결합의 쌍극자 모멘트는 서로 상쇄되기 때문에,

( 쌍극자 모멘트의 벡터 합 = 0 )
( 참고: 쌍극자 모멘트 https://ywpop.tistory.com/2581 )
이산화탄소는, 비록 극성 공유결합을 가지고 있지만,
무극성 분자가 됩니다.
( 참고: BCl3도 마찬가지 https://ywpop.tistory.com/11234 )

[그림] BCl3 분자의 기하 구조는 삼각평면.
B–Cl 결합은 극성 공유결합이나, BCl3 분자는 무극성 분자.


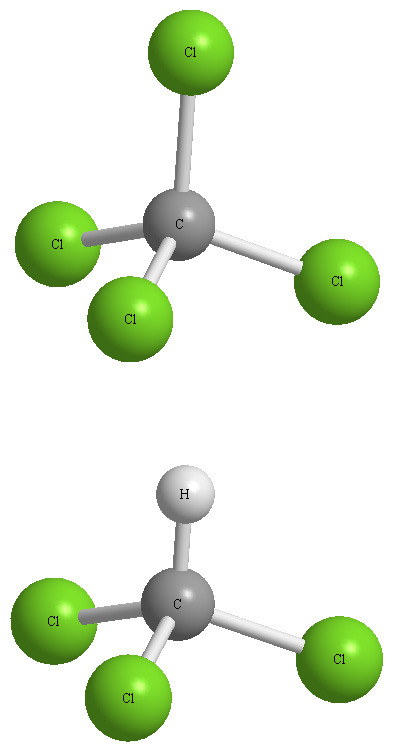
[그림] CCl4 분자는 무극성 분자, CHCl3 분자는 극성 분자.
C–Cl 결합은 극성 결합이나, CCl4는 무극성 분자.
( 참고 https://ywpop.tistory.com/14824 )
( 참고 https://ywpop.tistory.com/5942 )
[참고] C–H 결합은 무극성?
같은 원자끼리 결합은 100% 무극성 결합입니다.
예) H–H, O=O, N≡N
단, 유기 화합물에서,
C–H 결합은, 비록 다른 원자간 결합이나,
예외적으로 무극성 결합으로 ‘간주’합니다.
이유는 C와 H의 전기음성도 차이가 작기 때문에.
[ 관련 글 https://ywpop.tistory.com/14824 ] 결합의 쌍극자모멘트와 분자의 쌍극자모멘트. 대칭 구조인 CCl4 분자
[ 관련 예제 https://ywpop.tistory.com/11867 ] 극성 공유결합, 무극성 공유결합, 이온결합 고르기
[키워드] 극성 공유결합 기준문서, 극성 무극성 기준문서, 결합의 극성과 분자의 극성 기준문서, 결합의 쌍극자 모멘트와 분자의 쌍극자 모멘트 기준문서, 분자의 극성과 결합의 극성 기준문서, 분자의 쌍극자 모멘트와 결합의 쌍극자 모멘트 기준문서, 극성 무극성 사전, 결합의 극성과 분자의 극성 사전, 결합의 쌍극자 모멘트와 분자의 쌍극자 모멘트 사전, 분자의 극성과 결합의 극성 사전, 분자의 쌍극자 모멘트와 결합의 쌍극자 모멘트 사전, CCl4 polar or nonpolar, CCl4 루이스, CHCl3 polar or nonpolar, CHCl3 루이스, 서로 상쇄되는 기준문서, 서로 상쇄 기준문서
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 이온결합과 공유결합 중 더 강한 결합 (0) | 2015.11.18 |
|---|---|
| 이온결합과 공유결합. NH4Cl (0) | 2015.11.07 |
| NH4Cl이 왜 이온결합 화합물이죠? (1) | 2015.11.03 |
| SO3 루이스 구조 그리기. 삼산화황 ★ (1) | 2015.08.04 |
| NO3^- 루이스 구조 그리기. 질산 이온 (4) | 2015.07.14 |
| IO3^- 루이스 구조 그리기. iodate ion (0) | 2015.07.13 |
| 확장 팔전자 규칙 또는 18 전자 규칙 ★ (0) | 2015.07.12 |
| 이온 결합 화합물과 분자 화합물 구별 (3) | 2015.04.13 |



댓글