산의 세기에 영향을 주는 인자들
[1] 할로겐산

※ 전기음성도 차이로 산의 세기를 설명하는 교재도 있는데,
( 산의 세기 ∝ 전기음성도 차이 )
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
전기음성도 차이로는 다음 결과를 설명할 수 없다.
산의 세기: HF << HCl < HBr < HI
( 전기음성도 차이가 가장 큰 할로겐산은 HF인데, HF는 약산이다. )
① 보충설명: 왜 H–X 사이의 결합력이 클수록 약산인가?
H^+ 이온을 많이 내놓을수록 강산이다.
즉, 강산은 거의 100% 이온화되는 산이다.
H–X 사이의 결합력이 크면, H–X로 존재하지,
H^+ 이온과 X^- 이온으로 이온화되지 않는다.
---> H^+ 이온을 많이 내놓지 않는다. = 약산.
[참고] 결합에너지와 결합길이는 반비례하므로,
“결합길이가 더 길수록, 더 약산”이라고 설명할 수도 있다.
( 참고: 결합길이 https://ywpop.tistory.com/10143 )
② 보충설명: 왜 X^- 이온이 안정할수록 강산인가?
왜 짝염기가 안정할수록 강산인가?
왜 음이온이 비편재화될수록 강산인가?
음이온이 비편재화된다. = 음(–)의 성질이 약화된다.(옅어진다.)
= 이온의 성질이 약해져서 중성 비슷무리하게 된다.
음(–)의 성질이 약해지니, 양이온인 H^+ 이온과 재결합하려는 성질(힘)도 약해진다.
( 짝염기가 안정하니, 떨어져나간 H^+ 이온과 재결합 안해도 된다. )
이 때문에 한번 이온화된 H^+ 이온은 그대로 이온 상태로 존재한다.
---> 용액 중에는 H^+ 이온이 많다. = 강산이다.
[ 관련 글 https://ywpop.tistory.com/10557 ] HF의 결합 에너지가 가장 큰 이유
[2] 산소산. oxoacid
▶ 할로겐산을 제외하면, 나머지 산은 대부분 산소를 포함 → ‘산소산’이라 부름

( 산소 원자의 개수가 많을수록, 공명 구조의 개수 증가, 음이온이 보다 안정해짐. )
( 즉, 산소산의 세기는 “음이온의 안정도”로 설명. )
※ 산소산의 공명 구조

HClO < HClO2 < HClO3 << HClO4
( 참고: HClO, HClO2, HClO3는 약산,
HClO4는 강산 https://ywpop.tistory.com/5514 )
---------------------------------------------------
[예제] 산의 세기가 강한 순서대로 나열하시오.
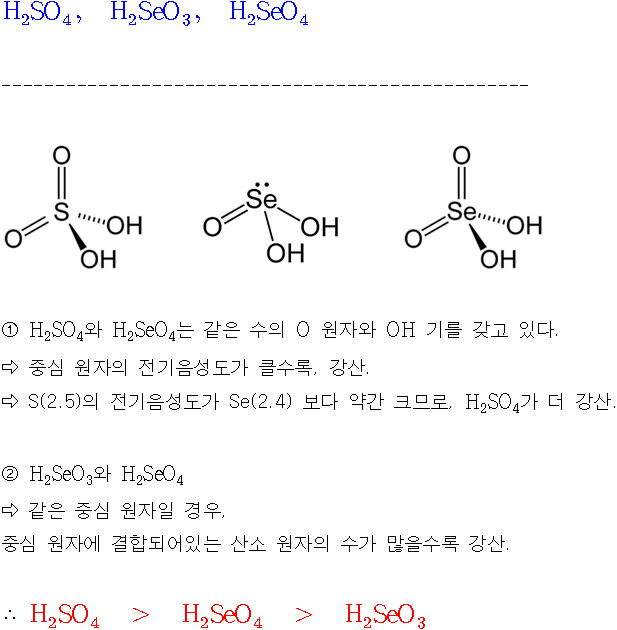
[ 관련 글 https://ywpop.tistory.com/3054 ] 산소산 명명법
[ 관련 글 https://ywpop.tistory.com/13413 ] 산의 세기 비교. FCH2CO2H > ClCH2CO2H > CH3CO2H
[ 관련 글 https://ywpop.tistory.com/6488 ] 황산과 질산의 산의 세기 비교
[ 관련 예제 https://ywpop.tistory.com/16250 ]
Choose the weaker acid in each of the following pairs:
a) HBr or HI ... b) H3AsO4 or H2SeO4 ... c) HNO3 or HNO2
[ 관련 예제 https://ywpop.tistory.com/16252 ]
Choose the stronger acid in each of the following pairs:
a) H2SeO3 or H2SeO4 ... b) H3PO4 or H3AsO4 ... c) H2S or H2Te
[키워드] 산의 세기 기준문서, 차아염소산, 아염소산, 염소산, 과염소산, 할로겐산의 세기 기준문서, 산소산의 세기 기준문서, 할로겐산 기준문서, 산소산 기준문서, 산의 세기 사전, HF가 약산인 이유 기준문서, 산소산 사전
'화학' 카테고리의 다른 글
| 염소산이온(ClO3-)의 몰농도(M) (1) | 2015.04.20 |
|---|---|
| 98% 황산(H2SO4, d=1.84)과 30% 황산(d=1.22)으로 50% 황산(d=1.40) 만들기 (2) | 2015.04.19 |
| 0.1 N NaOH solution = 0.1 M NaOH solution = 0.4% w/v NaOH solution (0) | 2015.04.18 |
| 진한 용액을 묽힐 때, 묽히기 전 용질의 몰수와 묽힌 후 용질의 몰수는 같다? (0) | 2015.04.18 |
| 산화-환원 반응 완성하기: Al + OH- → AIO2- + H2 (염기성 용액) (0) | 2015.04.17 |
| 산화-환원 반응 완성하기: Fe(OH)2 + O2 → Fe(OH)3 (염기성 용액) (6) | 2015.04.17 |
| 산소와 헬륨의 밀도 비 (0) | 2015.04.16 |
| 몰농도와 몰랄농도 (0) | 2015.04.16 |


댓글