클라우지우스-클라페이롱 식. Clausius-Clapeyron relation
---------------------------------------------------
▶ 참고: 제11장 액체와 분자간 힘. 목차
[ https://ywpop.tistory.com/15274 ]
---------------------------------------------------
▶ 액체의 증기압력 P와 절대온도 T 사이의 정량적인 관계식
▶ 액체의 증기압력 곡선을 직선으로 만든 식
▶ Clausius-Clapeyron 식
▶ 클라우지우스(독일)-클라페이롱(프랑스)

▶ 증기 압력 곡선: 온도에 따른 액체의 증기 압력을 나타낸 그래프
▶ 액체의 끓는점: 액체의 증기 압력과 대기압이 같을 때의 온도
▶ 액체의 정상 끓는점: 액체의 증기 압력이 760 torr일 때의 온도
▶ 증기압이 상승하면, 물질의 끓는점도 상승한다.
> 압력밥솥의 원리. 물이 100℃ 보다 높은 온도에서 끓기 때문에, 쌀이 더 빨리 익고, 밥맛도 더 좋아진다. 탄수화물은 고온에서 익히면 맛이 더 좋아진다.
> 물의 끓는점이 상승해서 물이 끓는데 그만큼 시간이 더 걸릴 수도 있으나, 일단 끓기 시작하면 온도가 더 높기 때문에 그만큼 음식이 더 빨리 조리되므로, 실제 밥 만드는 시간은 압력밥솥이 더 짧다.
[ 물의 상평형도로 설명 https://ywpop.tistory.com/2601 ]
▶ 증기압이 내려가면, 물질의 끓는점도 내려간다.
> 지리산 정상에서 밥을 지으면, 물이 100℃ 보다 낮은 온도에서 끓기 때문에, 쌀이 설익는다.
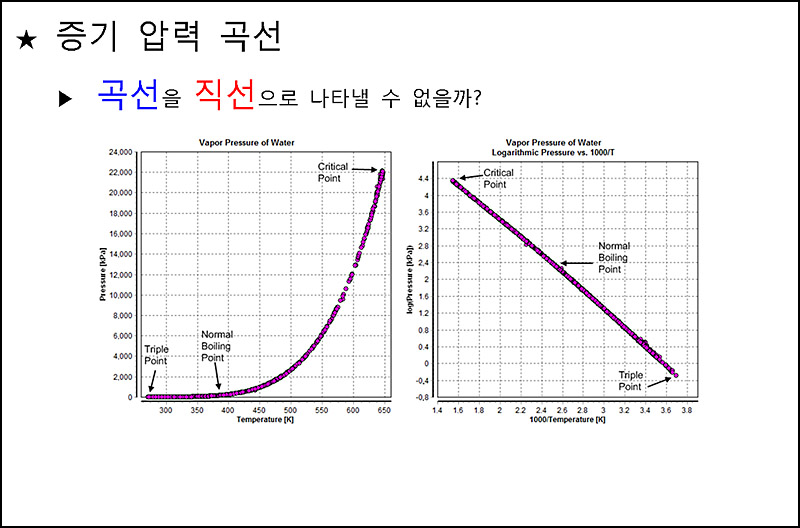
▶ 증기 압력 곡선
> 곡선을 직선으로 나타낼 수 없을까?

▶ Slope = –ΔH_vap / R
---> 직선의 기울기로부터,
액체의 증발 엔탈피(ΔH_vap)를 계산할 수 있다.
[ 관련 예제 https://ywpop.tistory.com/20456 ]
▶ ΔH_vap: 액체의 증발 엔탈피(=증발열) (kJ/mol)
> 액체 1 mol을 증발시키는데 필요한 에너지
---> 액체 분자간 힘의 세기의 척도
▶ 기체상수, R = 8.314 J/mol•K
[ 식 유도 과정 ]
dG = VdP – SdT
( 참고 https://ywpop.tistory.com/8354 )
일정 압력/온도에서 상 변화(phase change)할 때,
dG = VdP – SdT = 0
---> SdT = VdP
---> dP/dT = S/V

ln(P2/P1) = –ΔH_vap/R (1/T2 – 1/T1)
ln(P1/P2) = –ΔH_vap/R (1/T1 – 1/T2)
또는
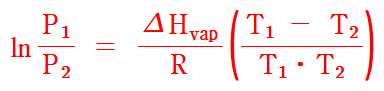
ln(P1 / P2) = ΔH_vap/R [(T1 – T2) / (T1•T2)]
증기압을 계산할 때는 다음 식이 가장 편리하다.
Clausius-Clapeyron 식
ln(P1 / P2) = ΔH_vap/R (1/T2 – 1/T1)
( 참고 https://ywpop.tistory.com/3133 )
ln(P1 / P2) = (ΔH_vap / 8.314) (1/T2 – 1/T1)
ΔH_vap = ln(P1 / P2) × R / (1/T2 – 1/T1)
ΔH_vap = ln(P1 / P2) × 8.314 / (1/T2 – 1/T1)
( 단위만 계산하면, ΔH_vap = J/mol•K / (1/T) = J/mol )
[ 참고 https://en.wikipedia.org/wiki/Clausius%E2%80%93Clapeyron_relation ]
[ 관련 예제 https://ywpop.blogspot.com/2023/11/blog-post_63.html ] 액체 질산의 증발열과 정상 끓는점
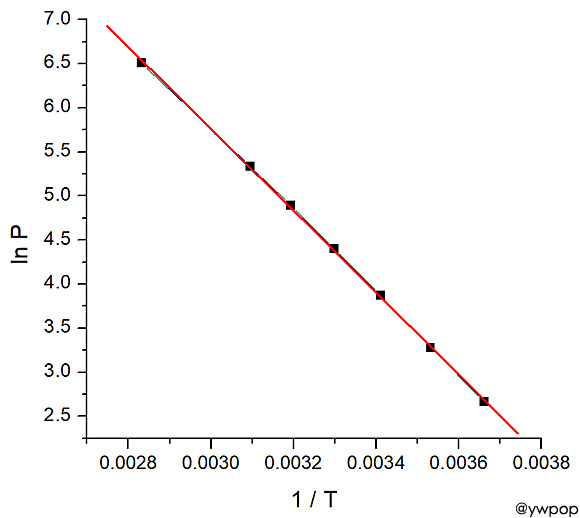
[ 관련 예제 https://ywpop.tistory.com/7980 ] 20℃에서 파이프 내부 암모니아의 압력
[ 관련 예제 https://ywpop.tistory.com/search/Clausius-Clapeyron ]
[키워드] 증발열 기준문서, 증발 엔탈피 기준문서, 정상 끓는점 기준문서, 클라우시우스-클라페이론 기준문서, 클라우시우스 기준문서, 클라우지우스 기준문서, 클라우 사전, 증발열 사전, 일반화학 11장 액체와 분자간 힘, dP/dT = ΔH P/RT^2, dP/dT = ΔH×P/RT^2, dP/dT = ΔH P/(RT^2), dP/dT = ΔH×P/(RT^2), dP/dT dic, dP/dT 기준문서, 클라우시우스 사전, 클라우지우스 사전, 선형 회귀분석 직선식
'일반화학 > [11장] 액체와 분자간의 힘' 카테고리의 다른 글
| 액체의 증발 엔탈피(enthalpy of vaporization). ΔH_vap (1) | 2016.06.02 |
|---|---|
| 물의 밀도가 4도씨에서 최대인 이유 (2) | 2016.03.10 |
| 분자간 힘. 유기 화합물의 끓는점 비교 (1) | 2015.06.19 |
| cholesteryl benzoate는 녹는점이 2개? (2) | 2015.05.15 |
| 액체의 증기 압력(vapor pressure) (0) | 2014.07.01 |
| 물에 대한 3가지 기체(질소, 일산화탄소, 산소)의 용해도 (0) | 2014.06.25 |
| Phase diagram. 상평형도 설명 (0) | 2014.06.14 |
| 물의 상평형도 (phase diagram of water) (0) | 2014.06.14 |



댓글