대기 중 이산화탄소(CO2)에 의한 산성비의 산도(pH)
정상 대기 중에는 이산화탄소(CO2)가 약 380 ppm 정도 존재한다.
이것이 대기 중 수분에 포화되었을 때의 산도(pH)는?
이 문제를 풀기 위해서는
Henry의 법칙, 산 이온화 상수, pH의 정의를 알고 있어야 한다.
( 참고: Henry의 법칙 https://ywpop.tistory.com/1911 )

기체의 압력은 기체 분자의 운동에 의해 발생하므로,
대기 중 기체의 양과 기체의 분압이 비례한다고 가정하면,
380 ppm = 380×10^(-6) atm
Henry 법칙으로부터
용해된(수분에 포화된) 이산화탄소의 몰농도를 계산하면,

용해된 이산화탄소는 다음과 같이 이온화하며,
> 1단계 (탄산의 생성): CO2(g) + H2O(l) → H2CO3(aq)
> 2단계 (탄산의 이온화): H2CO3(aq) ⇌ H^+(aq) + HCO3^-(aq)
> 전체 반응식

위 반응의 산 이온화 상수(평형상수) 값은 다음과 같다.
K_a1 = 4.45×10^(-7)
( 산 이온화 상수는 문헌값이며, 문헌값은
참고하는 문헌에 따라 다소 차이가 날 수 있다. )
이온화 반응식과 산 이온화 상수 값으로부터
평형에서의 수소이온 농도를 계산할 수 있다.

용해된 이산화탄소가 이온화되더라도
대기 중에서 이산화탄소가 계속 공급되기 때문에,
이산화탄소의 농도는 일정하다고 가정하면,
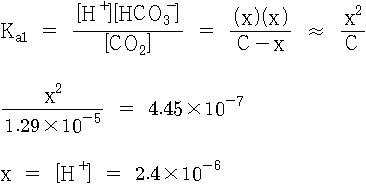
CO2(aq) + H2O(l) ⇌ H^+(aq) + HCO3^-(aq)
K = [H^+][HCO3^-] / [CO2]
K = x^2 / C
x = [K × C]^(1/2)
( 참고 https://ywpop.tistory.com/4294 )
= [(4.45×10^(-7)) (1.29×10^(-5))]^(1/2)
= 2.4×10^(-6) M = [H^+]
따라서 산도, 즉 pH는 다음과 같다.
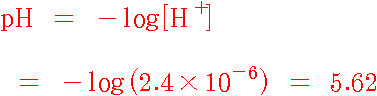
답: pH = 5.62
[ 참고: 탄산의 이온화상수(K_a1) 값 https://ywpop.tistory.com/4736 ]
H2CO3(aq) ⇌ H^+(aq) + HCO3^-(aq) ... K_a1 = 4.3×10^(-7)
[ 참고: Carbonic acid https://en.wikipedia.org/wiki/Carbonic_acid ]
[ 관련 예제 https://ywpop.tistory.com/9933 ] 25℃에서 대기 중에 노출된 물에 녹아있는 이산화탄소, CO2(aq)의 농도는 1.2×10^(-5) mol/L 정도이다. 이때 이 물의 pH는 얼마 정도인가?
[키워드] 이산화탄소와 산성비 기준문서, 산성비와 이산화탄소 기준문서, CO2와 산성비 기준문서, 산성비와 CO2 기준문서, CO2 380 ppm 기준문서
'화학' 카테고리의 다른 글
| 산-염기 암모니아, acid-base ammonia, NH3 (0) | 2014.11.25 |
|---|---|
| 밀도 단위변환, unit conversion g/mL to kg/m^3 (0) | 2014.11.24 |
| 산-염기 지시약 색깔 변화 ★ (2) | 2014.11.23 |
| 기체상수(gas constant), R (0) | 2014.11.23 |
| 무기화합물 명명법에서 괄호안의 로마숫자 ★ (0) | 2014.11.21 |
| N2와 O2의 분산력(London dispersion force) (0) | 2014.11.21 |
| 엔트로피와 상(phase)의 변화 예제 (0) | 2014.11.21 |
| 염화암모늄의 용해, dissolution of ammonium chloride (NH4Cl) (0) | 2014.11.21 |




댓글