열용량과 비열. heat capacity and specific heat
---------------------------------------------------
▶ 참고: 제5장 열화학. 목차
[ https://ywpop.tistory.com/15205 ]
---------------------------------------------------
모든 물질은 열을 가하면 온도가 변하지만,
일정량의 열에 의해 발생하는 온도 변화는 물질마다 모두 다릅니다.
⇨ 열용량 개념 필요
▶ 열용량의 정의
> ‘계(=물질)에 가해진 열(q)과 그 온도상승(ΔT)과의 비’를
열용량(C)이라 합니다.

> 열용량은 ‘계를 구성하는 물질의 온도가 얼마나 쉽게 변하는가?’ 또는
‘계를 구성하는 물질이 얼마나 효과적으로 열에너지를 축적하는가?’를 나타내는
척도가 될 수 있습니다.
예) 20℃ 물질 A, B에, ( 단, 비교하는 두 물질의 질량은 같다고 가정한다. )
100 J의 열을 가했을 때, A는 25℃, B는 30℃가 되었다면,

A의 열용량이 B 보다 더 크다는 것을 알 수 있으며, 이것은
⇨ A는 B 보다 온도가 쉽게 변하지 않는다.
⇨ A는 B 보다 열에너지를 잘 축적한다. 라고 설명할 수 있습니다.
( 참고: 열용량과 가열곡선의 기울기 https://ywpop.tistory.com/6689 )
> 즉, 외부 온도가 변할 때, 열용량(또는 비열)이 큰 물질은 온도가 약간만 변한다.
> 사람 몸무게의 70%는 물. 사람의 비열 ≒ 물의 비열.
---> 물의 비열은 다른 물질들보다 상당히 높기 때문에,
외부 온도가 변해도, 사람의 체온은 쉽게 변하지 않는다, 또는 약간만 변한다.
---> 인간이 열대지방, 극지방에서도 적응해서 생존할 수 있었던 이유 중 하나.
▶ 열용량은 크기 성질
> 물질의 열용량은 물질의 양에 의존하는 (크기 성질 | 세기 성질)입니다.
> 이 때문에 순수한 물질의 열용량은
일반적으로 일정한 물질의 양을 기준으로 나타내며,
기준하는 양의 종류에 따라, 2가지 정의가 있는데,
① 물질 1 mol에 대한 열용량을 몰열용량(molar heat capacity, C_m),
② 물질 1 g에 대한 열용량을 비열(Specific Heat, C_sp 또는 C_s)
이라고 합니다.
> 열용량은 물질의 양이 증가하면 증가하므로, 크기 성질.
> 반면에, 단위 질량당 열용량을 의미하는 “비열은 세기 성질”.
---> 물 100 mL의 비열과 물 1 L의 비열은 같다.
( 고등학교 이하에서는, 열용량의 개념이 나오지 않으므로,
비열을 이렇게 정의했습니다. )
▶ 비열: 물질 1 g의 온도를 1 K 올리는데 필요한 열량
( 또는 물질 1 g의 온도를 1 ℃ 올리는데 필요한 열량 )

▶ 1 cal의 정의
> 14.5℃ H2O(l) 1.0 g을 15.5℃ H2O(l) 1.0 g으로 만드는데 필요한 열
> 즉, 물 1.0 g의 온도를 1.0℃ 올리는데 필요한 열
( 1 cal = 4.184 J )
( 참고: 물의 비열과 잠열 https://ywpop.tistory.com/4948 )
( 참고: H2O의 몰질량 = 18.0153 g/mol )
▶ 몰열용량의 단위
> cal/mol•K = cal/mol•℃
> J/mol•K = J/mol•℃
▶ 비열의 단위
> cal/g•K = cal/g•℃
> J/g•K = J/g•℃
> kcal/kg•K = kcal/kg•℃
> kJ/kg•K = kJ/kg•℃
▶ 1 K 온도 구간과 1℃ 온도 구간
> 1 K 온도 구간과 1℃ 온도 구간은 같습니다.
이 때문에 문헌(핸드북)에서 비열의 단위를 나타낼 때,
J/g•℃ 또는 J/g•K 로, 둘 다 사용(표시)합니다.
> 즉, ΔK와 Δ℃의 숫자 값은 같습니다.
예를 들어, 섭씨온도로 온도가 20℃에서 50℃로 변했다면,
온도를 절대온도로 나타내면,
20 + 273.15 = 293.15 K
50 + 273.15 = 323.15 K
ΔK = 323.15 – 293.15 = 30 K
Δ℃ = 50 – 20 = 30℃
> 1 mol (또는 1 g) 만큼의 물질을 1 K만큼 온도를 높이는데 필요한 열량과
1 mol (또는 1 g) 만큼의 물질을 1℃만큼 온도를 높이는데 필요한 열량은 같다.
즉, 백원짜리 동전 1개를 1 K만큼 온도를 높이는데 필요한 열량과
백원짜리 동전 1개를 1℃만큼 온도를 높이는데 필요한 열량은 같다.
예) 물 50.0 g을 1.00 K 올리는데 209 J이 필요하다면, 물의 비열은?
---------------------------------------------------

비열의 정의로부터, 물질이 얻거나 잃은 열량을 계산할 수 있습니다.

> q = C m Δt
> q = C m
( 참고: 현열과 잠열 https://ywpop.tistory.com/19273 )
예) 물 466 g을 8.50℃에서 74.6℃까지 데웠다. 물이 흡수한 열량(kJ)은?
---------------------------------------------------

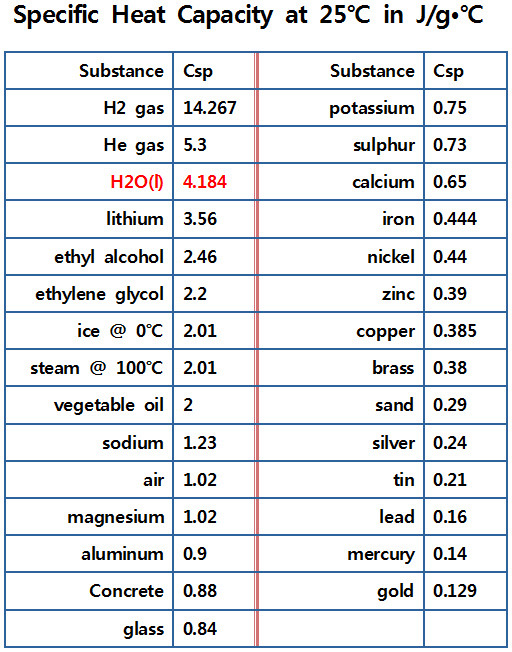
> 식용유의 비열 = 0.40 cal/g•℃ (1.67 J/g•℃)
( 식용유 = vegetable oil )
> olive oil의 비열 = 0.47 cal/g•℃ (1.97 J/g•℃)

[ 관련 글 https://www.engineeringtoolbox.com/specific-heat-capacity-d_391.html ] Specific Heat of common Substances
[ 관련 글 https://ywpop.tistory.com/23367 ] 정압비열과 정적비열. Cp and Cv
[ 관련 예제 https://ywpop.tistory.com/12670 ] 증기를 이용해 20℃ 물 1톤을 80℃까지 올리려면 몇 분 소요될까?
[ 관련 글 https://ywpop.tistory.com/16738 ] 모래의 비열과 온도 변화

고온 물질이 잃은 열(–q) = 저온 물질이 얻은 열(+q)
[ 관련 예제 https://ywpop.tistory.com/13965 ] 10 g 철 조각을 100℃로 가열하여 20℃ 물 50 g에 넣었을 때 철과 물의 최종 온도는?
[ 관련 예제 https://ywpop.tistory.com/21802 ] 60℃ 물 300 kg과 20℃ 물 800 kg을 혼합하면 물의 최종 온도는?
[키워드] 열용량과 비열 기준문서, 열용량의 정의 기준문서, 비열 도표, cmt 기준문서, 비열 사전, 열용량 사전, cmt dic
---------------------------------------------------
[비열과 열용량 구분]
(1) 물은 따뜻함이나 차가움을 오랫동안 유지할 수 있어 찜질팩의 내용물로 이용된다.
(2) 무거운 뚝배기로 요리를 하면 식탁에 올려놓아도 음식을 오랫동안 따뜻하게 유지할 수 있다.
열용량은 비열에 질량을 곱한 것이기 때문에,
비열이 같으면 질량이 클수록 열용량도 커진다.
즉, 같은 물질이면 무거울수록 열용량은 증가한다.
(1)번은 물이라는 물질 이름만 나왔기 때문에,
물질의 고유한 특성인 ‘비열’을 설명하는 것이다.
물의 비열은 다른 물질보다 상당히 크기 때문에,
물은 천천히 온도가 올라가고, 또한 천천히 온도가 내려간다.
즉, 비열이 큰 물질은 온도 변화가 느리게 일어난다.
사람 몸무게의 70%가 물이기 때문에
인간은 급격한 온도 변화에도 어느 정도 견딜 수 있다.
만약 물의 비열이 작았더라면,
인간은 약간만 더워도 쉽게 열사병에 걸리고,
약간만 추워도 쉽게 감기에 걸릴 것이다.
(2)번은 질량 개념인 ‘무거운’이란 단어가 나왔기 때문에,
즉 뚝배기라는 물질의 특성에 질량까지 생각했으므로,
‘열용량’을 설명하는 것이다.
뚝배기의 원료를 흙이라 가정하면
무거운 뚝배기는 무거운 흙, 가벼운 뚝배기는 가벼운 흙이다.
모두 같은 흙이기 때문에 비열은 같지만
질량이 더 큰 무거운 흙은 가벼운 흙보다 열용량이 더 크다.
열용량이 더 크다. = 열을 더 많이 가지고 있을 수 있다.
= 열을 더 많이 저장할 수 있다. 이므로,
무거운 뚝배기는 한번 가열시키면 그만큼 더 천천히 식는다.
이 때문에 음식을 오랫동안 따뜻하게 유지할 수 있다.
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 표준생성엔탈피를 이용한 표준반응엔탈피의 계산 ★ (3) | 2015.05.19 |
|---|---|
| 헤스 법칙, Hess’s law ★ (1) | 2015.05.02 |
| 0℃에서 500 mL의 물이 얼음으로 전환될 때 엔탈피 변화량 (0) | 2014.12.15 |
| 커피컵 열량계를 사용한 ΔH 측정. HCl + NaOH 중화열 측정 ★ (0) | 2014.11.30 |
| 반응열과 반응엔탈피의 관계 (0) | 2014.11.18 |
| ΔH 계산. 2Ag(s) + 1/2 O2(g) → Ag2O(s) 헤스 법칙 (1) | 2014.10.22 |
| 발열 반응 시 계와 주위의 온도 변화 (2) | 2014.10.02 |
| 우주(universe), 계(system), 주위(surrounding), 그리고 계의 3가지 형태 (0) | 2012.10.19 |



댓글