Cp – Cv = R. 엔탈피 정의로 설명
▶ Cp: 정압비열. 일정 압력(P) 조건 비열
> Cp = (dH / dT)p
▶ Cv: 정적비열. 일정 부피(V) 조건 비열
> Cv = (dU / dT)v
( 참고: 열용량의 정의 https://ywpop.tistory.com/2897 )
▶ 엔탈피의 정의
> H = U + PV
또는 H = E + PV
( 참고 https://ywpop.tistory.com/4672 )
▶ 이상 기체의 경우 (n = 1일 때),
> dH = CpdT
> dU = CvdT
> PV = RT
H = U + PV
dH = dU + d(PV)
CpdT = CvdT + d(RT)
CpdT = CvdT + RdT
만약 dT가 0이 아니라면,
Cp = Cv + R
Cp – Cv = R

[ 관련 글 https://ywpop.tistory.com/23639 ] 열역학 수식 정리. Cp – Cv = R
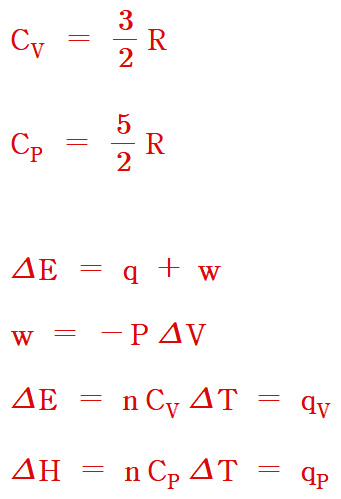
[ 관련 글 https://ywpop.blogspot.com/2025/01/09-kjkgk-07-kg-200-100.html ]
비열이 0.9 kJ/(kg•K), 질량이 0.7 kg으로 동일하며, 온도가 각각 200℃와 100℃인 두 금속 덩어리를 접촉시켜서 온도가 평형에 도달하였을 때 총 엔트로피 변화량은 약 몇 J/K인가?
[키워드] Cp – Cv = R 기준문서, Cp – Cv = R dic, ΔU = n Cv ΔT 기준문서, ΔH = n Cp ΔT 기준문서, ΔU = Cv ΔT 기준문서, ΔH = Cp ΔT 기준문서, ΔE = n Cv ΔT 기준문서, ΔE = Cv ΔT 기준문서, ΔU = nCvΔT 기준문서, ΔH = nCpΔT 기준문서, ΔU = CvΔT 기준문서, ΔH = CpΔT 기준문서, ΔE = nCvΔT 기준문서, ΔE = CvΔT 기준문서, q w ΔU ΔH 기준문서, q w ΔE ΔH 기준문서
'일반화학 > [19장] 화학 열역학' 카테고리의 다른 글
| 열역학 수식 정리. Cp – Cv = R (1) | 2023.04.27 |
|---|---|
| 55.40 g Xe 300 K 400 K heat ΔU ΔH ideal gas (1) | 2023.04.27 |
| 298 K Ar gas 1.00 dm3 30.00 dm3 isothermal expansion (1) | 2023.04.27 |
| 298 K ΔG° –4.5 kcal/mol Keq ΔH° –3.2 kcal/mol ΔS° (2) | 2023.04.11 |
| [ChatGPT] 고등학생에게 설명하는 엔트로피 (0) | 2023.02.22 |
| 298 K A → B + C kf 0.46 s-1 kr 1.5×10^-2 /M•s ΔG° (0) | 2022.12.09 |
| NH4HS total pressure 0.658 atm 25℃ free energy (0) | 2022.12.08 |
| 298 K Kp 0.113 5.40 kJ/mol P_NO2 = 0.122 atm P_N2O4 = 0.453 atm ΔG (0) | 2022.12.05 |
댓글