물의 높은 끓는점과 수소 결합
수소 결합 그래프의 2가지 이상한 점 (2)
---------------------------------------------------
▶ 참고: 분자간 힘, 반데르발스 힘
[ https://ywpop.tistory.com/2579 ]
---------------------------------------------------
수소 결합을 하는 3가지 화합물,

물의 끓는점이 가장 높다.
| 화합물 | 몰질량 | 정상 끓는점 |
| H2O | 18 g/mol | 373 K (100℃) |
| HF | 20 g/mol | 293 K (20℃) |
| NH3 | 17 g/mol | 240 K (–33℃) |
수소 결합은 쌍극자-쌍극자 힘의 특수한 형태이다.
이 말은 수소 결합의 본질은 ‘쌍극자-쌍극자 힘’이라는 것이다.
일반적으로 쌍극자-쌍극자 힘의 크기는
전기음성도 차이에 비례한다.
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
따라서 3가지 화합물의
쌍극자-쌍극자 힘의 크기 순서는 다음과 같다.

쌍극자-쌍극자 힘이 가장 큰 화합물의 끓는점이 가장 높을 것이다.
그렇다면 HF의 끓는점이 가장 높아야 되는데,
실험 결과는 물의 끓는점이 HF보다 훨씬 더 높았다.
왜 이런 결과가 나왔을까?
수소와 공유 결합한 원자(N, O, F)는 공통적으로 비결합 전자쌍을 갖고 있다.
3가지 화합물에서 비결합 전자쌍 수와 수소 원자 수를 비교해 보자.
| 화합물 | 비결합 전자쌍 수 | 수소 원자 수 |
| H2O | 산소 원자에 2개 | 2개 |
| HF | 불소 원자에 3개 | 1개 |
| NH3 | 질소 원자에 1개 | 3개 |
분자간 수소 결합을 자세히 들여다보면,
수소 결합은 한 분자의 수소 원자(부분 양전하를 띤)와
다른 분자의 N, O, F 원자에 존재하는
‘비결합 전자쌍’ 사이에서 일어난다.
HF는 불소 원자에 비결합 전자쌍이 3개씩이나 존재하지만,
수소 원자가 1개뿐이다.
암모니아는 수소 원자가 3개씩이나 존재하지만,
질소 원자에 비결합 전자쌍이 1개뿐이다.
그러나 물은 산소 원자에 비결합 전자쌍이 2개 존재하고,
또한 수소 원자도 2개 존재한다.
이와 같은 물의 구조적 특징 때문에,
아래 그림과 같이 물 분자는 주변의 다른 물 분자 4개와
연속적/규칙적/안정적으로 수소 결합을 할 수 있다.
( HF나 암모니아는 이렇게 규칙적으로 그릴 수 없다. )

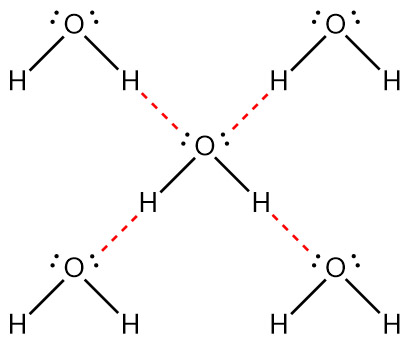
물의 끓는점이 HF나 암모니아보다 훨씬 높은 이유가 바로 여기에 있다.
액체 물 분자는 HF나 암모니아보다
더 많은 수소 결합으로 서로 연결되어 있기 때문에,
각각의 수소 결합을 끊고 기체가 되려면
더 많은 에너지가 필요하므로,
물의 끓는점이 가장 높은 것이다.
( 이렇듯 수소 결합은 물질의 끓는점을 연구하다가 알게 되었다. )
---------------------------------------------------
[보충 설명]
수소 결합은 영구쌍극자-영구쌍극자 힘의 한 종류이므로,
전기음성도 차이가 가장 큰 HF의 수소 결합이 가장 강할 것으로 예상된다.
즉, 전기음성도 차이가 F–H > O–H > N–H 순이므로,
수소 결합의 세기는 HF > H2O > NH3 순으로 예상된다.
그러나 분자간 힘의 척도인 끓는점을 조사하면,
H2O > HF > NH3 순으로,
H2O의 끓는점이 월등히 더 높다.
이 사실은 H2O의 수소 결합이 훨씬 더 강하다는 것을 의미한다.
왜 이런 실험 결과가 나왔을까?
H2O는 수소 결합에 참여할 수 있는
비공유 전자쌍 2개와 수소 원자 2개가 존재하기 때문에,
H2O는 한 분자당 동시에 4개의 수소 결합이 가능하다.
이 때문에 H2O는 어느 한쪽 수소 결합이 끊어지더라도
다른 쪽 수소 결합에 의해 분자간 힘이 유지될 수 있다.
반면에,
HF는 수소 결합에 참여할 수 있는 전자쌍은 3개이나 수소 원자는 1개뿐이고,
NH3는 수소 결합에 참여할 수 있는 수소 원자는 3개이나 전자쌍은 1개뿐이기 때문에,
HF와 NH3는 한 분자당 오로지 1개의 수소 결합만 가능하다.
이런 차이로 인해,
개별 결합의 수소 결합의 세기는 HF가 가장 강하지만,
분자 전체적인 수소 결합의 세기는 H2O가 가장 강하다.
H2O의 끓는점이 HF보다 월등히 높은 이유는 바로 이 때문이다.
[ 관련 글 https://www.quora.com/Why-is-H2O-having-the-highest-hydrogen-bonding-than-HF-and-NH3 ] Why is H2O having the highest hydrogen bonding than HF and NH3?
[ 관련 글 https://ywpop.tistory.com/8663 ] 수소 결합 그래프의 2가지 이상한 점 (1)
[키워드] 끓는점과 수소결합 기준, 수소결합과 끓는점 기준, 수소결합 기준, 수소결합 사전
[23/02/16 수정]
'일반화학 > [11장] 액체와 분자간의 힘' 카테고리의 다른 글
| Phase diagram. 상평형도 설명 (0) | 2014.06.14 |
|---|---|
| 물의 상평형도 (phase diagram of water) (0) | 2014.06.14 |
| 상평형도(phase diagram) (0) | 2014.06.13 |
| 임계 온도와 임계 압력 (4) | 2014.06.13 |
| 수소 결합 (hydrogen bond) ★ (0) | 2014.06.09 |
| 분자의 크기와 분산력, 끓는점 비교 (0) | 2014.06.05 |
| 순간 쌍극자와 London 분산력 ★ (0) | 2014.06.04 |
| 유도쌍극자, 유발쌍극자, 분극성, 편극성 (0) | 2014.06.03 |




댓글