수소 결합. hydrogen bond
---------------------------------------------------
▶ 참고: 분자간 힘, 반데르발스 힘 (van der Waals force)
[ https://ywpop.tistory.com/2579 ]
---------------------------------------------------
수소(H) 원자가
수소 원자보다 전기음성도가 더 큰
질소(N), 산소(O), 불소(F) 원자와 공유 결합하면,
수소와 이들 3개 원자 사이의 전기음성도 차이로 인해,
수소 원자에 부분 양전하(δ+)가 형성된다.
( 아래 그림 참조 )
( 참고: 전기음성도 https://ywpop.tistory.com/2567 )
이때,
수소 원자의 부분 양전하와
다른 분자의 부분 음전하 (또는 음이온) 사이의
쌍극자-쌍극자 힘 (또는 쌍극자-이온 힘)을
‘수소 결합’이라고 한다.
[주목] 수소 결합은
한 분자와 주변의 다른 분자 (또는 이온) 사이에 작용하는
‘분자간 힘’이다.
주의할 점은 수소 ‘결합’이란 이름이 붙여졌다고 해서,
이 상호작용이 분자내 원자간 결합을 뜻하는
‘화학 결합’은 아니라는 것이다.
즉, 수소 결합 역시 쌍극자-쌍극자 힘일 뿐인데,
다만 특별히 좀 더 강해서,
특별히 힘 대신 결합이란 이름을 붙여준 것이다.
( 참고: 화학 결합과 분자간 힘 https://ywpop.tistory.com/5995 )
▶ 분자간 힘, 즉 수소 결합을 포함한 모든 반데르발스 힘은
분자내 원자간 결합인 공유 결합에 비하면,
아주 약한 힘이다.
[주목] N, O, F 원자와 공유 결합한 수소 원자와
수소 결합하려는 이웃 분자의 원자(또는 이온)는
반드시 ‘비결합 전자쌍’을 갖고 있어야만 한다.

▶ 수소 결합은
> 특수한 형태의 쌍극자-쌍극자 힘 ⇨ 특별히 강하다.
> 화합물의 끓는점 연구과정에서 제안된 힘.
[주목] 화학식에 O와 H, N과 H, F와 H가 있다고 해서,
무조건 수소 결합이 가능하다고 생각하지 말 것.
반드시 분자 내에 O–H, N–H, F–H 결합이 존재해야 수소 결합이 가능하다.
즉, H는 O, N, F와 직접 결합하고 있어야 수소 결합이 가능하다.
예를 들어, CH3F는 F–H 결합이 없기 때문에, 수소 결합이 불가능하다.

[ 관련 예제 https://ywpop.tistory.com/10248 ] 물과 수소 결합을 형성할 수 없는 화합물
[ 관련 예제 https://ywpop.tistory.com/11233 ] 수소 결합을 형성할 수 없는 분자
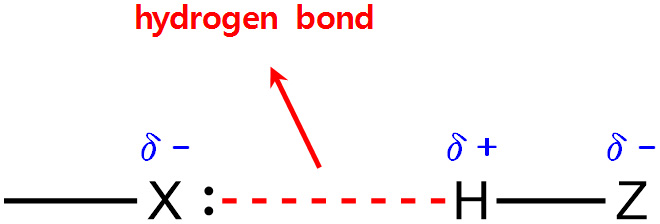
[수소 결합 일반식]
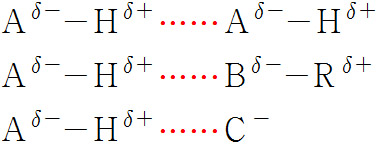
> A = N, O, F
> 실선 = 분자내 공유 결합
> 점선 = 분자간 수소 결합
[물 분자의 수소 결합]
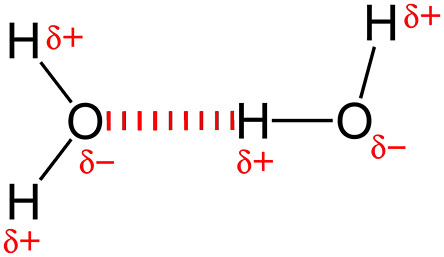
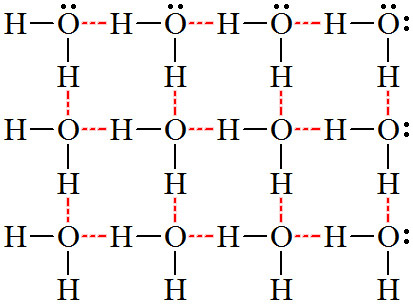
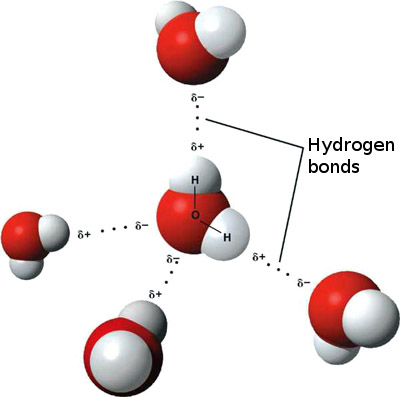
그림과 같이 1개 물 분자는 최대 4개까지
다른 물 분자와 수소 결합이 가능하다.
이 때문에 분자량이 비슷한 다른 어떤 물질보다,
( 설령 그 물질이 수소 결합이 가능할지라도 )
물의 끓는점은 다른 물질보다 훨씬 더 높다.
( 참고 https://ywpop.tistory.com/2597 )
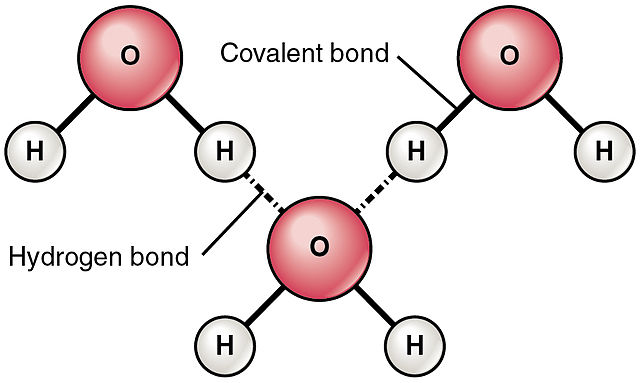
[ 그림 출처 Wikimedia ] 공유 결합과 수소 결합.
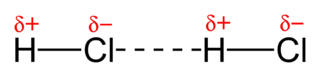
[ 그림 출처 Wikimedia ] 공유 결합과 쌍극자-쌍극자 힘.
점선은 수소 결합이 아니다.
The molecules of HCl, HBr and HI
do not form a hydrogen bond.
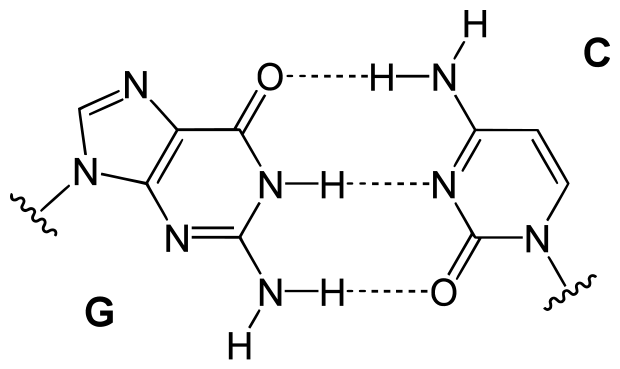
[ 그림 출처 Wikimedia ] 점선은 모두 수소 결합이다.
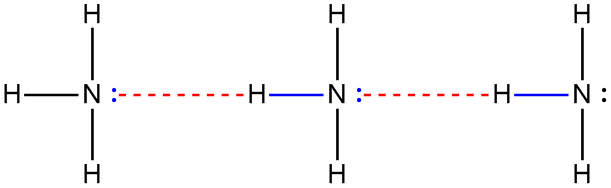
[ 그림 ] 암모니아의 수소 결합.
Hydrogen bonding between ammonia, NH3.
( 참고: CH3NH2 수소결합 https://ywpop.tistory.com/23926 )
[참고] 수소 결합을 확대해석할 경우,
X와 Z는 N, O, F가 아니어도 된다고 하는 의견도 있다.
( 참고 https://www.adichemistry.com/general/chemicalbond/hbond/hydrogen-bonding.html )
chloroform의 H와 acetone의 O 사이의 분자간 힘도
수소 결합이라고 설명한다.
이쯤 되면 필자도 헷갈린다.
( 이 부분은 일반적인 수소 결합의 범주에 포함되지 않으므로, 참고만 하자. )
[ 관련 글 https://ywpop.tistory.com/8663 ] 수소 결합 그래프의 2가지 이상한 점. 이걸 어찌 설명할꼬?
[키워드] 수소결합 기준, 수소결합 사전, 수소 결합 기준, 수소 결합 사전, 수소결합 경전, 수소 결합 경전
'일반화학 > [11장] 액체와 분자간의 힘' 카테고리의 다른 글
| 물의 상평형도 (phase diagram of water) (0) | 2014.06.14 |
|---|---|
| 상평형도(phase diagram) (0) | 2014.06.13 |
| 임계 온도와 임계 압력 (4) | 2014.06.13 |
| 물의 높은 끓는점과 수소 결합 (0) | 2014.06.12 |
| 분자의 크기와 분산력, 끓는점 비교 (0) | 2014.06.05 |
| 순간 쌍극자와 London 분산력 ★ (0) | 2014.06.04 |
| 유도쌍극자, 유발쌍극자, 분극성, 편극성 (0) | 2014.06.03 |
| 분자간 힘, 반데르발스 힘(van der Waals force) (1) ★ (0) | 2014.06.02 |




댓글