728x170
NO2(g) 1몰 N2O4(g) 생성 기체의 총 몰수 0.8몰
밀폐된 용기에 NO2(g) 1몰을 넣었더니
일부가 반응하여 N2O4(g)가 생성되었다.
이때 용기 속에 존재하는 기체의 총 몰수가 0.8몰이었다면,
남아있는 NO2와 N2O4의 분자수 비는?
---------------------------------------------------
ICE 도표를 작성하면,
.................2NO2(g) ⇌ N2O4(g)
초기(mol): 1 ............... 0
변화(mol): –2x ........... +x
평형(mol): 1–2x .......... x
평형에서,
(1–2x) + x = 0.8
1 – x = 0.8
x = 1 – 0.8 = 0.2
평형에서,
> NO2의 몰수 = (1–2x) = 1 – 2(0.2) = 0.6 mol
> N2O4의 몰수 = 0.2 mol
분자수 비(= 몰수 비) 를 계산하면,
NO2 : N2O4 = 0.6 : 0.2 = 3 : 1
답: 3 : 1
[ 관련 예제 https://ywpop.tistory.com/22892 ] 2NO2(g) ⇌ N2O4(g) K = 1.15 NO2 0.650 mol/L
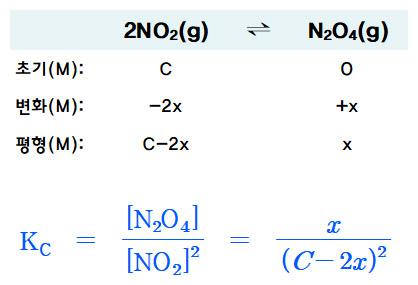
[키워드] 2NO2(g) ⇌ N2O4(g) ice 기준문서, 2NO2(g) = N2O4(g) ice 기준문서
반응형
그리드형(광고전용)
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| 0.0472 NO(g) + SO3(g) ⇌ SO2(g) + NO2(g) 0.862 atm (5) | 2023.05.21 |
|---|---|
| 25℃ Kc = 0.145 2BrCl ⇌ Br2 + Cl2 0.220 mol BrCl 250 mL CCl4 (0) | 2023.05.17 |
| 25℃ Kc = 0.145 2BrCl ⇌ Br2 + Cl2 0.0450 M (3) | 2023.05.17 |
| Kc = 4.3×10^5 HCO2H(g) ⇌ CO(g) + H2O(g) (1) | 2023.05.17 |
| N2O4 1.588 g 298 K 500 cm3 1.0133 bar N2O4 NO2 mol fraction (0) | 2023.04.02 |
| A + B ⇌ C + D 반응의 평형 상수가 144 (0) | 2023.01.16 |
| K = 6.40×10^(-7) 0.250 mol CO2(g) in 1.000 L container (2) | 2023.01.02 |
| 0.055 mol CO and 0.072 mol Cl2 in 5.0 L K 0.20 (0) | 2023.01.02 |

댓글