2BrCl ⇌ Br2 + Cl2 Kc = 0.145 0.220 mol BrCl 250 mL CCl4
The reaction 2BrCl ⇌ Br2 + Cl2 has a Kc = 0.145 in CCl4 at 25℃.
If 0.220 mol of BrCl is dissolved in 250 mL of CCl4,
what will be the concentration of BrCl, Cl2 and Br2
when it reaches equilibrium?
---------------------------------------------------
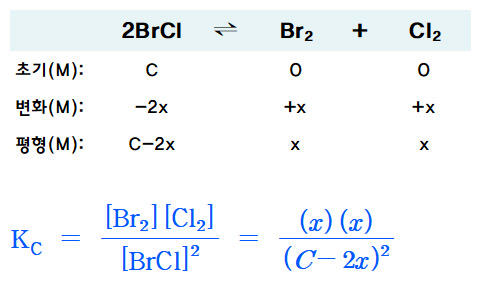
[BrCl] = 0.220 mol / 0.250 L = 0.88 M
ICE 도표를 작성하면,
............. 2BrCl .. ⇌ .. Br2 .. + .. Cl2
초기(M) . 0.88 ........... 0 ........... 0
변화(M) . –2x ............ +x .......... +x
평형(M) . 0.88–2x ..... x ............ x
Kc = [Br2] [Cl2] / [BrCl]^2
0.145 = (x) (x) / (0.88 – 2x)^2
0.145 = x^2 / (0.88 – 2x)^2
0.145 = [x / (0.88 – 2x)]^2
0.145^(1/2) = x / (0.88 – 2x)
x = (0.145^(1/2))(0.88) – (0.145^(1/2))(2x)
(1 + (0.145^(1/2))(2))x = (0.145^(1/2))(0.88)
x = (0.145^(1/2))(0.88) / (1 + (0.145^(1/2))(2))
= 0.190224
= 0.19 M
답:
[BrCl] = 0.88 – 2x = 0.88 – 2(0.19) = 0.50 M
[Cl2] = [Br2] = 0.19 M
[검산]
Kc = 0.19^2 / 0.50^2 = 0.1444 ≒ 0.145
[ 동일 예제 https://ywpop.tistory.com/23758 ]
[ 관련 예제 https://ywpop.tistory.com/23754 ] 각 물질의 초기 농도가 0.0450 M 이라면, 이들의 평형 농도는 얼마인가?
[ 관련 예제 https://ywpop.tistory.com/6108 ] 500 K의 용기 안의 BrCl(g) 초기 부분압력이 0.500 atm이고, 평형에 도달하였을 때 부분압력이 0.40 atm이라면, 500 K에서의 Kp 값을 구하시오.
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| H2(g) + I2(g) ⇌ 2HI(g) Kc 57 at 700 K 1 mol H2 1 mol I2 in 1 L (0) | 2022.06.20 |
|---|---|
| [H2O(g)] = 7.9×10^(-2) M, [CO2(g)] = 0.93 M, [O2(g)] = 2.4×10^(-3) M (0) | 2022.06.01 |
| 350 K 10 L 2 mol SO3 SO2 : SO3 0.663 (0) | 2022.05.18 |
| 0.050 mol CH2O 500 mL CH2O(g) = H2(g) + CO(g) 0.066 mol/L (1) | 2022.05.13 |
| CO2 H2 3.0 mol 500℃ CO 1.0 mol H2O 1.0 mol (0) | 2022.04.09 |
| A(s) ⇌ B(s) + C(g) 평형 반응에 대한 설명 (0) | 2022.02.14 |
| Write expressions for K. 2NH3(g) + CO2(g) ⇌ N2CH4O(s) + H2O(g) (2) | 2022.01.03 |
| 평형상수식. CuO(s) + H2(g) ⇌ Cu(l) + H2O(g) (2) | 2022.01.03 |

댓글