ΔH 계산. 2NH3(g) + 1/2 O2(g) → N2H4(l) + H2O(l)
Calculate ΔH for the reaction
2NH3(g) + 1/2 O2(g) → N2H4(l) + H2O(l)
given the following data:
1) 2NH3(g) + 3N2O(g) → 4N2(g) + 3H2O(l) ... ΔH = –1010 kJ
2) N2O(g) + 3H2(g) → N2H4(l) + H2O(l) ... ΔH = –317 kJ
3) N2H4(l) + O2(g) → N2(g) + 2H2O(l) ... ΔH = –623 kJ
4) H2(g) + 1/2 O2(g) → H2O(l) ... ΔH = –286 kJ
---------------------------------------------------
▶ 참고: 헤스의 법칙 [ https://ywpop.tistory.com/3376 ]
※ 헤스의 법칙을 이용한 이런 유형의 문제는
간단한 원리만 이해하면, 끼워 맞추기 ‘놀이’에 불과하다.
---> 불행히도, 이 문제는, 예외적으로,
재수없을 때나 걸리는 조금 복잡한 문제이다.
2NH3(g) + 1/2 O2(g) → N2H4(l) + H2O(l)
---> 이 식을 ‘타깃’이라 한다.
1)식은 타깃의 2NH3(g)에 맞춰, 그대로 사용한다.
1) 2NH3(g) + 3N2O(g) → 4N2(g) + 3H2O(l) ... ΔH = –1010 kJ
2)식은 타깃의 N2H4(l)에 맞춰, 그대로 사용한다.
2) N2O(g) + 3H2(g) → N2H4(l) + H2O(l) ... ΔH = –317 kJ
---> 보통은 이렇게 하면 되는데...
---> 문제는 이렇게 하면 1)식의 3N2O(g)를 소거할 수 없다.
1)식의 3N2O(g)를 소거하기 위해,
2)식은 ×3 하고, 역반응을 취한다.
5) 3N2H4(l) + 3H2O(l) → 3N2O(g) + 9H2(g) ... ΔH = 3(+317) kJ
3)식은 타깃의 N2H4(l)와 5)식의 3N2H4(l)를 고려하여,
3)식은 ×4 하고, 역반응을 취한다.
( 즉, 5)식과 6)식을 더했을 때, 생성물 쪽에 N2H4(l)이 남아있어야 된다. )
6) 4N2(g) + 8H2O(l) → 4N2H4(l) + 4O2(g) ... ΔH = 4(+623) kJ
마지막 4)식은 H2(g), O2(g), H2O(l)을 정리하는데 사용한다.
이때 전체 반응식들 중에서 개수가 가장 작은 H2(g)로 정리하면 좋겠다.
그러면, 이론적으로 O2(g), H2O(l)의 개수는 자동적으로 함께 맞춰진다.
만약 이렇게 안 되면 주어진 식들이 잘못된 것이다.
5)식의 9H2(g)를 소거하기 위해,
4)식은 ×9 한다.
7) 9H2(g) + 9/2 O2(g) → 9H2O(l) ... ΔH = 9(–286) kJ
그러고 나서
1), 5), 6), 7)식을 더하면, shows target...
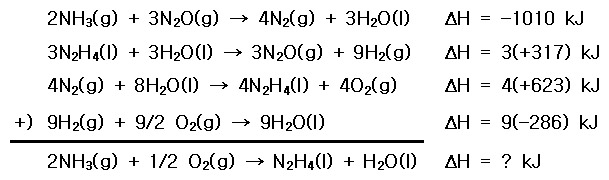
.. 2NH3(g) + 3N2O(g) → 4N2(g) + 3H2O(l) ... ΔH = –1010 kJ
.. 3N2H4(l) + 3H2O(l) → 3N2O(g) + 9H2(g) ... ΔH = 3(+317) kJ
.. 4N2(g) + 8H2O(l) → 4N2H4(l) + 4O2(g) ... ΔH = 4(+623) kJ
+) 9H2(g) + 9/2 O2(g) → 9H2O(l) ... ΔH = 9(–286) kJ
-------------------------------------------------------
.. 2NH3(g) + 1/2 O2(g) → N2H4(l) + H2O(l) ... ΔH = ? kJ
따라서
? = (–1010) + (3(+317)) + (4(+623)) + (9(–286))
= –141 kJ
( That easy. 참 쉽죠? )
( 이 문제는 쉽다고 할 수 없군요... )

[키워드] bob ross 기준문서
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 90℃ 물 100.0 g + 10℃ 물 100.0 g (3) | 2021.08.04 |
|---|---|
| 90℃ water 100.0 g + 10℃ water 500.0 g (1) | 2021.08.04 |
| 10℃ 물 50.0 g + 90℃ 철 50.0 g (1) | 2021.08.04 |
| 결합엔탈피로 반응엔탈피 계산. CH4 + 3Cl2 → CHCl3 + 3HCl (0) | 2021.07.28 |
| 0.0℃ 1.00 atm 39.1 mol He volume 876 L 38.0℃ 998 L q w ΔE 20.8 J/℃ (0) | 2021.07.08 |
| 52.5 J heat 0.500 atm 58.0 L 102.5 J volume (0) | 2021.07.07 |
| 정반응 활성화에너지는 125 kJ/mol, ΔE는 –216 kJ/mol (3) | 2021.06.21 |
| 규소 45.0 g을 6.0℃ 올리기 위해서는 192 J이 필요 (0) | 2021.06.16 |
댓글