Hydrogen-like Atom. Bohr Model 관계식


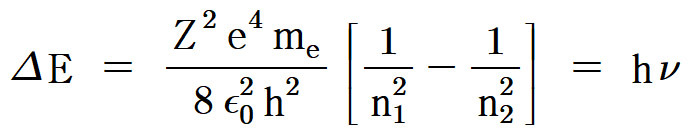
ΔE = R_H (1/n_i^2 – 1/n_f^2)
= 2.18×10^(-18) J × (1/n_i^2 – 1/n_f^2)
( 참고 https://ywpop.tistory.com/14147 )
[ 관련 예제 https://ywpop.tistory.com/3122 ] 수소 원자에서 방출되는 빛의 에너지와 파장 계산
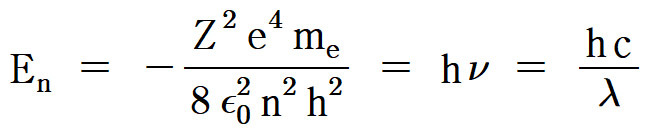

> 원자 번호, Z (for hydrogen, Z = 1)
> 기본 전하량, e = 1.602×10^(-19) C
> 전자의 질량, m_e = 9.109×10^(-31) kg
> 유전율, ε_0 = 8.854×10^(-12) F/m
> 플랑크 상수, h = 6.626×10^(-34) J•s
> R_H = Rydberg constant
> 빛의 속도, c = 3×10^8 m/s
[Rydberg equation]

1/λ = R_H (1/n_f^2 – 1/n_i^2)
> R_H = 1.097×10^7 m^(-1)
( 참고 https://ywpop.tistory.com/14147 )
( R_H = 1.096 775 83 × 10^7 m^(-1) )
[ 관련 글 https://ywpop.blogspot.com/2024/06/paschen-series-infrared-series-for.html ]
Paschen series. infrared series for hydrogen
[ 관련 글 https://ywpop.tistory.com/11696 ]
He^+의 n=4 → n=3 전이에서 방출되는 빛의 파장(nm)을 구하라.
[The energy of a hydrogen-like atom (or ion)]

> En = –R_H (Z^2 / n^2)
> En = –13.6 eV × (Z^2 / n^2)
> En = –2.18×10^(-18) J × (Z^2 / n^2)
> En = –2.178×10^(-18) J × (Z^2 / n^2)
[ 관련 글 https://ywpop.blogspot.com/2024/05/the-electron-energy-in-hydrogen-atom.html ]
the electron energy in hydrogen atom the energy of an electron in hydrogen atom
수소 원자의 전자 에너지. 수소 원자에 있는 전자의 에너지

[ 관련 예제 https://ywpop.tistory.com/24102 ] The energy of a hydrogen-like atom (or ion ) in its ground state is –122.4 eV. It may be
[ 관련 예제 https://ywpop.tistory.com/24100 ] The ionization energy of Li^2+ atom in ground state
[ 관련 글 https://ywpop.tistory.com/9049 ] 보어가 완성한 수소 원자의 n번째 궤도의 에너지 계산식
[ 관련 글 https://ywpop.tistory.com/9792 ] Rydberg constant 계산
[키워드] 보어 기준, Bohr 기준, 보어 모델 기준, Bohr Model 기준, 에너지 준위 계산 기준, 에너지 준위 기준, 보어 사전, Bohr dic, 보어 모델 사전, Bohr Model dic, 에너지 준위 계산 사전, 에너지 준위 사전, hydrogen-like atom dic, 보어 식 기준, 보어 식 사전, 보어 계산식 기준, 보어 관계식 기준, 보어 계산식 사전, 보어 관계식 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 35번 Br의 전자배치 (0) | 2020.05.25 |
|---|---|
| 수소 원자가 방출하는 빛의 에너지와 파장. n=4 → n=3 (3) | 2020.05.24 |
| 파장이 285 nm인 빛의 에너지(kJ) (0) | 2020.05.23 |
| Cs의 일함수. 400 nm 1.54×10^(-19) J (3) | 2020.05.22 |
| Cr의 전자배치. electron configuration of Cr (0) | 2020.04.26 |
| 빛의 입자설과 광전 효과 (0) | 2020.03.14 |
| 바닥상태의 Cr 원자에서 m_l = 0인 전자수 (0) | 2020.02.11 |
| 금속 철의 일함수는 451 kJ/mol. 파장 계산 (1) | 2019.11.12 |

댓글