redox balance. Fe + O2 → Fe2O3
산화-환원 반응 완성하기. Fe + O2 → Fe2O3
---------------------------------------------------
▶ 참고: 산화-환원 반응 균형 맞추기 (산성 용액)
[ https://ywpop.tistory.com/4264 ]
---------------------------------------------------
생성물이 1개이고, 그 생성물이 이온결합 화합물이면,
다음과 같이 생성물을 이온식으로 나타낸 다음,
Fe2O3 → 2Fe^3+ + 3O^2-
( 참고: 이온식 만들기 https://ywpop.tistory.com/8390 )
반쪽 반응식으로 나눈다. 즉,
Fe + O2 → Fe2O3 반응식이 아닌,
Fe + O2 → 2Fe^3+ + 3O^2- 반응식을 가지고
반쪽 반응식으로 나눈다.
1. 반쪽 반응식 나누기
산화: Fe → 2Fe^3+ (Fe의 산화수는 0에서 +3으로 증가, Fe는 산화됨.)
환원: O2 → 3O^2- (O의 산화수는 0에서 –2로 감소, O2는 환원됨.)
( 산화제=O2, 환원제=Fe )
> Fe is a reducing agent, O2 is an oxidizing agent.
2. 질량 균형 맞추기
산화: 2Fe → 2Fe^3+
환원: 3O2 → 6O^2- (2와 3의 최소공배수는 6)
3. 전하 균형 맞추기
산화: 2Fe → 2Fe^3+ + 6e^-
산화: 2(0) = 2(+3) + 6(–1)
환원: 3O2 + 12e^- → 6O^2-
환원: 3(0) + 12(–1) = 6(–2)
4. 주고받은(이동한) 전자 수 같도록
산화: 2Fe → 2Fe^3+ + 6e^- (×2)
환원: 3O2 + 12e^- → 6O^2-
산화: 4Fe → 4Fe^3+ + 12e^-
환원: 3O2 + 12e^- → 6O^2-
( Fe는 전자를 잃었다. Fe는 산화됨. )
( O2는 전자를 얻었다. O2는 환원됨. )
5. 반쪽 반응식 더하기
4Fe + 3O2 → 4Fe^3+ + 6O^2-
이온식을 화학식(분자 반응식)으로 나타내면, 끝.
4Fe + 3O2 → 2Fe2O3
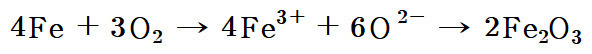
[ 관련 글 https://ywpop.tistory.com/470995 ]
4Fe + 3O2 → 2Fe2O3 반응에서 O2 1몰 반응할 때 이동한 전자는 4몰
[ 관련 글 https://ywpop.blogspot.com/2023/11/redox-fe-o2-fe2o3.html ]
redox Fe + O2 → Fe2O3
[ 관련 글 https://ywpop.tistory.com/9731 ] 강철솜의 연소 반응
[키워드] redox Fe + O2 기준, redox Fe + O2 → Fe2O3, redox 4Fe + 3O2 → 2Fe2O3, redox Fe2O3 기준, redox Fe + O2 dic, redox Fe + O2 → Fe2O3 dic, redox 4Fe + 3O2 → 2Fe2O3 dic
'일반화학 > [20장] 전기화학' 카테고리의 다른 글
| 기전력 계산. 2Au + 3Ca^2+ → 2Au^3+ + 3Ca (0) | 2019.02.13 |
|---|---|
| H2의 당량수. 수소 분자의 당량수 (1) | 2019.01.30 |
| 자동차 축전지 산화-환원 반응 (충전 반응) (0) | 2019.01.18 |
| 전기분해의 화학량론. 0.500 g Ag 10.0 mA 19300초 (0) | 2019.01.05 |
| redox balance. I^- + IO3^- → I3^- (acidic) (1) | 2018.12.18 |
| redox balance. Fe(OH)2 + O2 → Fe(OH)3 (basic) (1) | 2018.12.17 |
| redox balance. Mn^2+ + H2O2 → MnO2 + H2O (basic) (0) | 2018.12.16 |
| redox SO2 + H2S → H2O + S (0) | 2018.12.16 |


댓글