전이 원소. 전이 금속. transition metals
---------------------------------------------------
▶ 참고: 제23장 전이 금속과 배위 화학. 목차
[ https://ywpop.tistory.com/19815 ]
---------------------------------------------------
▶ 전이원소의 정의
> 중성 원자일 때나 양이온이 되었을 때,
d 오비탈에 전자가 부분적으로 채워진 원소
( d 오비탈에 9개 이하의 전자가 존재하는 원소 )
▶ The IUPAC definition defines a transition metal as
“an element whose atom has a partially filled d sub-shell,
or which can give rise to cations with an incomplete d sub-shell”.
[표] 4주기 전이금속의 원자가전자


> 전이금속의 d 오비탈에 존재하는 전자는
화학 결합에 참여하기 때문에,
원자가전자에 포함시킨다.
> 예를 들어, 4주기 전이금속의 경우,
3d 전자와 4s 전자 모두가 원자가전자이다.
> A, B 구분없이, 1~18로 나타낸 족의 숫자를
원자가전자의 수로 보면 된다.
예) 11족 전이금속의 원자가전자 수 = 11개
▶ 3B~8B족, 1B족(, 2B족) 원소
( 참고: 주기율표 그림 https://ywpop.tistory.com/8715 )
( 2B족인 Zn은 교재(학자)에 따라 전이원소에서 제외되기도 한다. )
( Zn은 항상 +2가의 산화수를 가진다. 즉, +2가 양이온이 된다. )
( 드물지만, +1가 Zn도 있다. 아래 내용 참고. )
[참고] 2B족인 Zn, Cd의 산화수(산화 상태)는
거의 대부분 화합물에서 +2, 극히 드물게 +1.
---> 몇몇 교재(저자)는 이들을 전이금속에서 제외.
---> 이들을 명명할 때 로마숫자도 생략.
> Zn(NO3)2의 IUPAC name: zinc nitrate
> Cd(NO3)2의 IUPAC name: cadmium(II) nitrate
---> 대부분 논문에서 cadmium nitrate라고 명명하고 있다.
( 참고 https://www.sciencedirect.com/topics/chemistry/cadmium-nitrate )
▶ 전이원소는 모두 금속 ⇨ 전이금속

[그림] 4주기, 5주기 전이금속.
[ 참고: 4주기, 5주기 전이금속의 원자가전자 https://ywpop.tistory.com/2844 ]
[ 참고: 원자가 전자 수 결정 방법 https://ywpop.tistory.com/2866 ]
[ 참고: 전형 원소와 전이 원소 https://ywpop.tistory.com/5893 ]
---------------------------------------------------
전이금속의 특징
▶ 부분적으로 채워진 d 오비탈 때문에...
① 다양한 산화수. multiple oxidation states
( 다양한 산화수 = 다양한 이온전하 )
② 색깔. colored compounds
( 참고 https://ywpop.tistory.com/15748 )
③ 자기적 성질. magnetic properties
전이금속의 산화수. oxidation states of transition metals
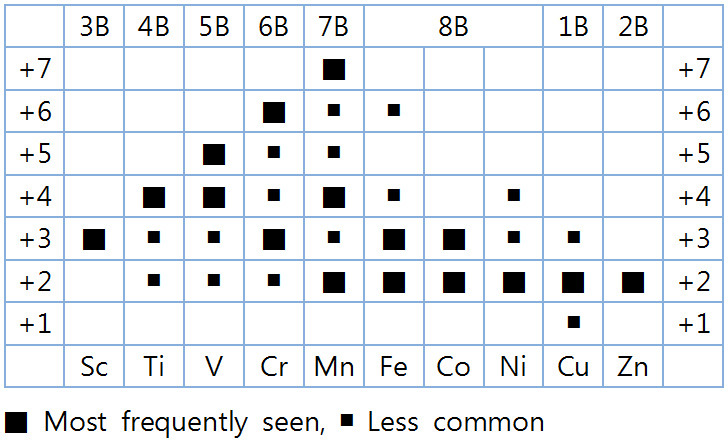
예를 들면, 화합물에서 Mn이 가질 수 있는
가장 일반적인 산화수(= 이온 전하)는 +2, +4, +7 이다.
> MnCl2에서 +2, MnO2에서 +4, KMnO4에서 +7
이렇듯, 전이금속은 화합물의 종류에 따라서,
다수의 다양한 이온 전하를 가질 수 있기 때문에,
전이금속의 이온 전하는 따로 암기할 필요가 없다.
---> 산화수는 계산할 줄 알고 있을 테니, 계산하면 된다.
[주목] 3B~7B족 전이금속의
가장 일반적인 산화수(이온전하)는 ‘족의 수’와 같다.
※ 일반적으로 금속은 족의 일의자리 수와 같은 전하의 양이온이 되고,
비금속은 (8 – 족의 일의자리 수)와 같은 전하의 음이온이 된다.
> 1족인 Na의 산화수 = +1, 2족인 Ca의 산화수 = +2.
> 16족인 O의 산화수 = –2, 17족인 Cl의 산화수 = –1.
( 참고 https://ywpop.tistory.com/4841 )
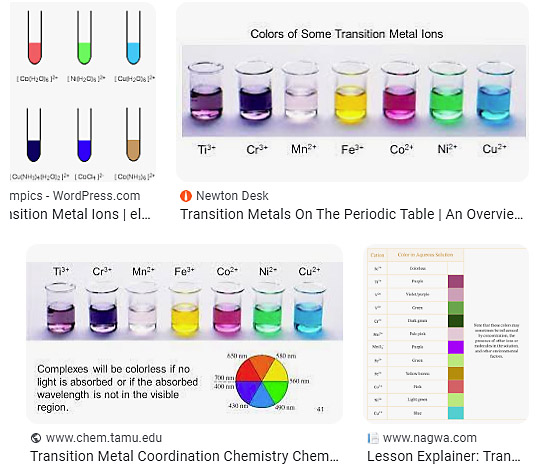
[그림] transition metal colors in aqueous solution.
구글 이미지 검색 결과 중 일부.
[ 관련 글 https://ywpop.tistory.com/22811 ] Mn의 산화수 = +1. [Mn(CN)6]^5-
[ 관련 글 https://ywpop.tistory.com/18770 ] Co(OH)2에서 Co의 산화수
[ 관련 글 https://ywpop.tistory.com/8159 ] 구리의 산화수
[ 관련 글 https://ywpop.tistory.com/22090 ] 구리가 +2가 양이온인 이유
[ 관련 글 https://ywpop.tistory.com/2844 ] 크롬(Cr)과 구리(Cu)의 전자배치 예외
[ 관련 글 https://ywpop.tistory.com/2959 ] 왜 전이금속은 다양한 산화수를 가질까?
[ 관련 글 https://ywpop.tistory.com/3012 ] 무기화합물 명명법에서 괄호안의 로마숫자
---------------------------------------------------
[참고] +1가의 Zn 이온, Zn2^2+
No compounds of zinc in oxidation states other than +1 or +2 are known.
( 참고 https://en.wikipedia.org/wiki/Zinc )
zinc(I) compounds, Zn2Cl2
Zn2Cl2 → Zn2^2+ + 2Cl^-
Zn2^2+ 이온은 Hg2^2+ 이온과 유사한 형태.
[Zn2]^2+ 이온은 [Hg2]^2+ 이온과 유사한 형태.
( 참고: Hg2^2+의 구조 https://ywpop.tistory.com/12488 )
---------------------------------------------------
[참고] 가장 높은 산화수를 가진 물질. 원자번호 77 이리듐(Ir, iridium)
> Ir은 6주기 전이금속
> Ir의 바닥상태 전자배치: [Xe] 4f^14 5d^7 6s^2
> Ir의 원자가 전자 수 = 9개 (5d^7 6s^2)
( 참고 https://ywpop.tistory.com/2866 )
> IrO4 화합물에서, Ir의 산화수 = +8
> IrO4 화합물에서, Ir의 전자배치 = 5d^1
---> 5d^1 전자를 제거하면, +9가 되지 않을까?
---> A team have successfully formed the [IrO4]^+ cation in the gas phase
using pulsed-laser vaporization of an iridium metal target,
and identified it using photodissociation spectroscopy.
( 기체 상태의 [IrO4]^+ 양이온을 합성, [IrO4]^+ 양이온에서 Ir의 산화수 = +9. )
( 그러나 중성인 화합물(염)은 아직 합성하지 못함. )
[ 출처 https://www.nature.com/articles/nature13795 ]
[키워드] 전이금속 기준, 다양한 산화수 기준, 자기적 성질 기준, 색깔 기준, 전이금속 사전
'일반화학 > [23장] 전이 금속과 배위 화학' 카테고리의 다른 글
| Co^3+ 착이온의 흡수 파장 (0) | 2018.11.26 |
|---|---|
| [Fe(H2O)6]^2+ 착이온은 상자기성 물질 (0) | 2018.11.26 |
| 염화아연에는 왜 염화아연(II)처럼 로마숫자를 안 붙일까 (0) | 2018.04.16 |
| 배위화학. 배위화합물(coordination compound), 착물(complex) (0) | 2017.10.08 |
| 착 이온(complex ion)과 배위 화합물(coordination compound) (0) | 2017.06.12 |
| d 오비탈 분리. 결정장 분리 (Crystal Field Splitting) (0) | 2017.01.24 |
| K4[Fe(CN)6]의 자기적 성질 (0) | 2016.12.07 |
| 몇 가지 일반적인 리간드 (Some Common Ligands) ★ (0) | 2016.02.13 |




댓글