인의 분자식. 황의 분자식. P4와 S8

▶ 인(Phosphorus)의 분자식: P4
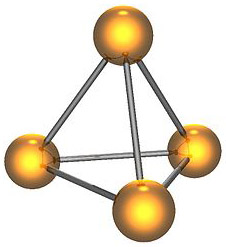
[ 그림 출처 Wikimedia ] 인의 동소체 중 하나인 P4의 결정 구조.
Crystalline structures of some phosphorus allotropes.
( 참고: 동소체 https://ywpop.tistory.com/5760 )
> P4(s, white)의 표준 생성 엔탈피, ΔH°_f = 0 (ΔG°_f = 0)
▶ 황(Sulfur)의 분자식: S8
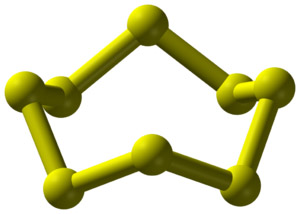
[ 그림 출처 Wikimedia ] Structure of the cyclooctasulfur molecule, S8.
> S(s, rhombic)의 표준 생성 엔탈피, ΔH°_f = 0 (ΔG°_f = 0)
( 참고: Rhombic sulphur )

화학자들끼리 약속이니,
인과 황의 분자식은 그냥 암기할 것.
---> 화학에서 이런 경우는 인과 황, 이거 2개밖에 없다.
[주의] 인과 황의 분자식이 비록 P4, S8 이지만,
화학 반응식에서, P4, S8 대신,
그냥 P, S 를 사용하는 경우도 있다.
예) 2P(s) + 5Cl2(g) → 2PCl5(s)
예) S(s) + O2(g) → SO2(g)
[ 관련 예제 https://ywpop.tistory.com/10702 ]
이것은 탄소, 즉 흑연을 사용할 때,
그냥 C를 사용하는 것과 같다고 보면 된다.
예) C(s, 흑연) + O2(g) → CO2(g)
[참고] 개인적으로,
P4, S8 대신, P, S 를 사용하는 것은 못마땅하게 생각한다.
첫째, 학생들에게 혼란을 주기 때문이다.
둘째, P(s), S(s)는 C(s)와 완전 다르기 때문이다.
[주의] P(s)는 인 분자, S(s)는 황 분자를 의미하고,
C(s)는 탄소 ‘원소’를 의미한다.
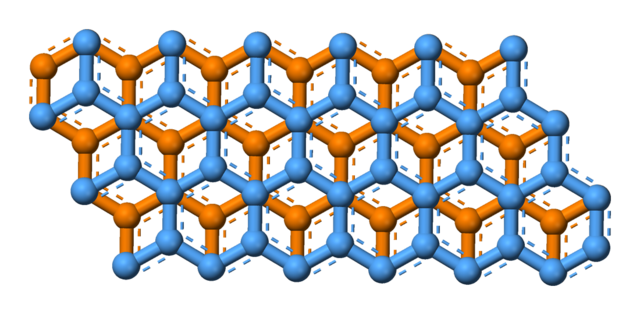
[그림] C(s, 흑연)의 구조. 흑연은 위와 같은 구조가 무한히 반복된다.
이 때문에 흑연은, 즉 C(s)는 분자가 아닌 원소라고 부른다.
[ 관련 글 https://ywpop.tistory.com/10685 ] 분자가 아닌 이유
[ 관련 글 https://ywpop.tistory.com/13747 ] 균형 맞추기. P4 + 5O2 → P4O10
[키워드] 인의 분자식 기준, 황의 분자식 기준, 인의 화학식 기준, 황의 화학식 기준
, P4 기준, S8 기준, P의 분자식 기준, S의 분자식 기준, P4 dic, P4 S8 dic
'일반화학 > [22장] 비금속 화학' 카테고리의 다른 글
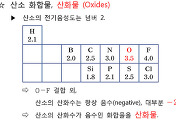
| 할로겐 이원자분자의 물리적 상태 (0) | 2018.01.15 |
|---|---|
| 공기의 분리. 질소 제조. 산소 제조 (0) | 2017.11.27 |
| 2주기와 3주기 원소의 π 결합 (1) | 2017.07.23 |
| 산성산화물, 염기성산화물, 양쪽성산화물 ★ (0) | 2017.04.11 |
| 탄화물. 카바이드(carbide) (0) | 2017.03.24 |
| 할로겐의 성질. 할로겐간 산화-환원 반응 (0) | 2017.02.20 |
| 수소 생산, 수소 제조 (0) | 2017.01.10 |
| 과산화물과 초과산화물. peroxides and superoxides (0) | 2016.11.12 |

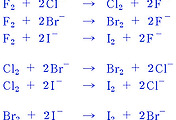
댓글