2차 표준용액(0.1 N HCl)을 이용한 0.1 N NaOH 용액의 역가 측정
염기 표준용액으로 많이 쓰이는 NaOH는
공기 중에서 물을 잘 흡수하기 때문에 정밀하게 칭량하는 것이 어렵다.
이 때문에 필요한 농도의 용액을 (대략적으로) 조제하고 역가를 구하여 사용한다.
흔히 NaOH 용액의 역가를 측정(표정)할 때는 2차 표준용액인 HCl 용액을 이용한다.
예를 들어,
▶ 2차 표준물질인 HCl 용액의 농도(N) = 0.1 N,
역가(F) = 1.03, 적정에 사용한 양(V) = 30 mL
▶ 표정하려는 NaOH 용액의 농도(N´) = 0.1 N,
적정에 소비된 양(V´) = 30.5 mL
HCl과 NaOH는 당량 대 당량으로 반응하므로,
다음 공식을 이용하여 0.1 N NaOH 용액의 역가를 산출할 수 있다.
N × V × F = N´ × V´ × F´
( 참고 https://ywpop.tistory.com/6934 )
0.1 × 30 × 1.03 = 0.1 × 30.5 × F´
F´ = (0.1 × 30 × 1.03) / (0.1 × 30.5) = 1.01
F´ = 1.01
[참고] 따라서 대략적으로 조제한 NaOH 용액의 실제 농도, 즉 정확한 농도는
0.1 N × F = 0.1 × 1.01 = 0.101 N 이다.
[키워드] 표준용액의 표정 기준문서, 표준용액의 역가 기준문서, 표준용액의 factor 기준문서, 역가를 구하는 이유 기준문서, factor를 구하는 이유 기준문서, NaOH 용액의 역가 측정 기준문서, NaOH 용액의 역가 기준문서, NVF = N’V’F’ 기준문서
---------------------------------------------------
[참고] 역가를 측정하는 이유. factor를 측정하는 이유
NaOH는 조해성 성질 때문에, 정확한 농도의 용액을 만들기 어렵다.
NaOH처럼, 1차 표준용액을 정확한 농도로 만들기 어려울 경우,
일단은 대충, 대략적인 농도의 1차 표준용액을 만들고 나서,
( 예를 들면, 용액 제조에 4.000 g의 NaOH가 필요하지만,
대충 3.900~4.100 g 사이의 질량을 재빨리 달아서 용액을 만든다. )
정확한 농도로 만들기 쉬운 2차 표준용액으로 적정하여,
factor를 결정, 1차 표준용액의 정확한 농도를 결정한다.
[ 관련 글 https://ywpop.tistory.com/10262 ] 표정의 정의. 표준화의 정의
'화학 > 용액의 농도' 카테고리의 다른 글
| 98% 황산 시약(d 1.84, FW 98)의 몰농도와 노르말농도 (0) | 2016.11.10 |
|---|---|
| 용액의 몰농도와 부피, 용질의 몰질량(순도, 밀도)으로 용액 만들기 (2) | 2016.11.02 |
| Na2S2O3 용액의 몰농도 = 노르말농도 (0) | 2016.10.30 |
| 노르말농도의 정의 ★★ (18) | 2016.10.28 |
| 농도변경. %농도를 %농도로 변경. 퍼킨스 계산법 (2) | 2016.10.26 |
| 황산 49 g이 들어있는 500 mL 용액의 노르말농도 (0) | 2016.10.18 |
| 50 ppm FeCl3 용액의 몰농도 (0) | 2016.10.15 |
| 0.025 N KMnO4 용액 1 L 제조에 필요한 KMnO4 질량(g) (0) | 2016.10.08 |
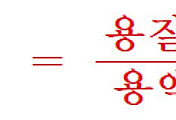

댓글