왜 포화탄화수소보다 불포화탄화수소가 더 불안정한가요?
포화탄화수소는 탄소-탄소 결합이 단일결합뿐이고,
불포화탄화수소는 탄소-탄소 결합이
다중결합을 포함하고 있기 때문입니다.
그렇다면,
왜 다중결합을 포함하고 있으면 더 불안정한가요?
다중결합은 시그마(σ) 결합 1개와
파이(π) 결합 1개 이상을 포함하고 있는데,
파이 결합이 시그마 결합보다 결합세기가 약하기 때문입니다.
( 파이 결합이 시그마 결합보다 불안정하기 때문입니다. )
이 때문에 파이 결합이 파괴되어 새로운 결합이 잘 만들어집니다.
> 단일 결합: 1개의 시그마 결합
> 이중 결합: 1개의 시그마 결합 + 1개의 파이 결합
> 삼중 결합: 1개의 시그마 결합 + 2개의 파이 결합

( 참고: MO 이론. 시그마결합과 파이결합 https://ywpop.tistory.com/15979 )
그렇다면,
왜 파이 결합은 더 불안정한가요?
이 이유는 3가지로 설명 가능합니다.
1) 시그마 결합은 head-to-head overlap으로 결합이 형성되고,
파이 결합은 side-by-side overlap으로 결합이 형성되기 때문에,
겹쳐지는 부분의 전자밀도가 더 낮습니다.
( 이 때문에 파이 결합의 결합세기가 더 약합니다. )
2) 전자의 위치 또한 시그마 전자보다 바깥쪽(외곽)에 있습니다.
( 이 때문에 친전자체(electrophile)의 공격을 더 받기 쉽습니다. )

[그림] 아세틸렌(C2H2)의 삼중결합. 1개의 시그마 결합과 2개의 파이 결합.
C와 C 사이에 있는 노란색 전자밀도는 시그마 결합을,
하늘색, 보라색 전자밀도는 각각 파이 결합을 나타낸다.
외부에서 친전자체가 공격한다면, 어느 곳부터 먼저 공격할까?
---> 가장 바깥쪽 결합부터, 가장 약한 결합부터 공격.
3) 파이 결합을 만드는 오비탈(p_y, p_z)의 에너지 준위가 더 높기 때문에,
파이 결합은 에너지적으로도 더 불안정합니다.

[그림] sp 혼성 오비탈의 형성.
비혼성 오비탈인 p_y, p_z 오비탈의 에너지 준위는
sp 혼성 오비탈의 에너지 준위보다 높다.
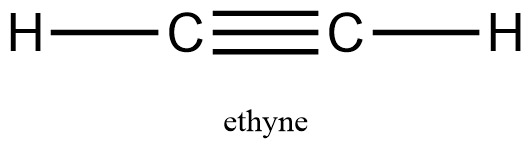
[그림] ethyne의 루이스 구조. C2H2의 루이스 구조.
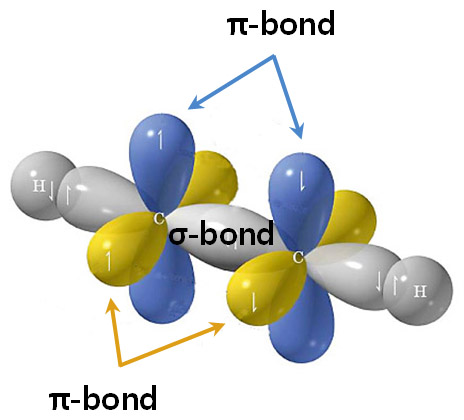
[그림] 아세틸렌의 삼중결합. 1개의 σ-결합과 2개의 π-결합.
두 원자 사이의 σ-결합은 오로지 단 1개만 가능하다.
[ 관련 글 https://ywpop.tistory.com/2938 ] 탄소의 sp2, sp 혼성 오비탈
---------------------------------------------------
▶ 시그마결합과 파이결합
> σ-결합: 양쪽 오비탈의 머리끼리 겹쳐져서 (head-to-head overlap) 만들어진 결합
> π-결합: 양쪽 오비탈의 옆면끼리 겹쳐져서 (side-by-side overlap) 만들어진 결합
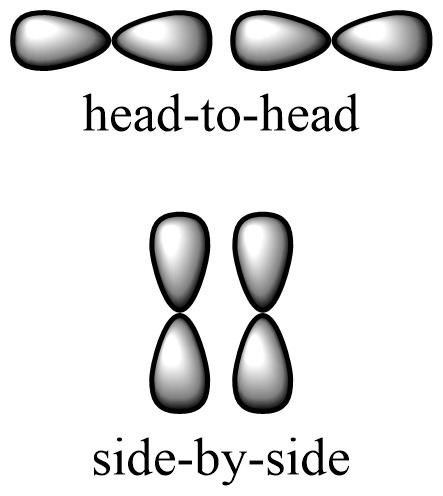
[그림] σ-결합 형성과 π-결합 형성.
위 그림만 보면 π-결합이 더 많이 겹칠 수 있다고 생각할 수도 있다.
그러나 head-to-head overlap은
양쪽 오비탈이 글자 그대로 완전히 겹쳐지지만,
side-by-side overlap은
양쪽 오비탈이 일정한 거리를 두고서
오비탈 옆쪽 사이의 공간 상에서 겹쳐지기 때문에,
겹침에 의해 형성된 결합 전자의 밀도를 고려하면,
head-to-head overlap이 훨씬 더 높다.
( 아세틸렌의 삼중결합 그림을 다시 보세요. )
> s 오비탈의 모양은 구형이므로, s 오비탈은 σ-결합만 가능.
> p 오비탈의 모양은 아령형이므로, p 오비탈은 σ-결합, π-결합, 둘 다 가능.
( 참고: σ MO와 π MO https://ywpop.tistory.com/12763 )
[ 관련 글 https://ywpop.tistory.com/9897 ] 다중결합의 자유회전은 불가능
---------------------------------------------------
▶ 단일결합과 다중결합의 전자밀도
시그마결합의 전자밀도는 파이결합보다 더 높기 때문에,
단일결합의 전자밀도가 다중결합보다 더 높은 것이 맞지요?
---> 아닙니다.
시그마결합 1개와 파이결합 1개를 비교하면,
시그마결합의 전자밀도가 더 높지만,
다중결합은 글자 그대로, [시그마결합 + 파이결합] 이므로,
즉 시그마결합의 전자밀도에, 비록 시그마결합보다 전자밀도가 낮지만,
파이결합의 전자밀도를 더한 것이므로, 다중결합의 전자밀도가 더 높습니다.
또한 이 때문에 다중결합의 결합세기 역시 단일결합보다 더 큽니다.
( 참고: 결합 엔탈피 https://ywpop.tistory.com/2558 )
결합의 안정/불안정과 결합 세기를 혼동하지 말자.
다중결합이 더 불안정하다고
다중결합의 결합 세기가 더 약하다는 것은 아니다.
결합 세기는 단일결합보다
다중결합의 결합 세기가 더 강하다(크다).
[ 관련 글 https://ywpop.blogspot.com/2024/07/2.html ]
이중결합의 결합에너지가 단일결합의 결합에너지의 두 배가 아닌 이유
[키워드] 시그마 결합 기준문서, 시그마결합 기준문서, 시그마 결합 파이 결합 기준문서, 시그마결합 파이결합 기준문서, 알켄의 반응성 기준문서, 다중 결합의 반응성 기준문서, 이중 결합의 반응성 기준문서, 다중 결합 기준문서, 시그마 결합 사전, 파이 결합 사전, 다중 결합 사전, C2H2 루이스 구조, 아세틸렌 기준문서, 아세틸렌 사전, 2개 파이 결합 기준문서, 파이 결합 2개 기준문서, 2개 파이 결합 사전, 파이 결합 2개 사전, 시그마 결합 사전, 시그마결합 사전, 시그마 결합 파이 결합 사전, 시그마결합 파이결합 사전, 공격하기 더 쉽다 기준, 공격받기 더 쉽다 기준, 공격하기 더 쉽기 때문 기준, 공격받기 더 쉽기 때문 기준
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 옥텟 규칙, 옥텟 룰(octet rule)의 예외. 전이원소의 옥텟규칙 ★ (0) | 2016.07.23 |
|---|---|
| 염산은 공유결합물질인데 어째서 전해질이 되나요 (0) | 2016.06.28 |
| 결합 엔탈피 값은 평균값 (0) | 2016.05.30 |
| CO 루이스 구조 그리기. 일산화 탄소 (0) | 2016.05.07 |
| 이온결합 화합물의 녹는점. NaCl MgO KCl CaO (0) | 2016.02.09 |
| 이온결합과 공유결합 중 더 강한 결합 (0) | 2015.11.18 |
| 이온결합과 공유결합. NH4Cl (0) | 2015.11.07 |
| NH4Cl이 왜 이온결합 화합물이죠? (1) | 2015.11.03 |



댓글