ClO 루이스 구조 그리기. Chlorine monoxide radical
Lewis structure of ClO. Chlorine monoxide radical
------------------------
[참고] 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
ClO = (Cl) + (O)
= (7) + (6) = 13
[2단계] 화합물의 기본 골격 구조를 그린다.
( 단일결합 수만큼 전자 수를 뺀다. )
Cl–O
13 – 2 = 11
[참고] 루이스 구조 그릴 때 중심원자 결정
Cl–O에서 중심원자는 산소(O)이다.
( 참고 https://ywpop.tistory.com/6766 )
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )
( 그린 전자 수만큼 뺀다. )
( 괄호 안 숫자는 비결합전자수 )
Cl(6)–O
11 – 6 = 5
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
Cl(6)–O(5)
5 – 5 = 0
---> 남아있는 전자가 5개뿐이므로,
중심원자인 산소(O)는 팔전자 규칙을 만족하지 못한다.
---> ClO는 팔전자 규칙 예외 물질이다.
( 참고 https://ywpop.tistory.com/8577 )
---> ClO는 홀전자가 존재하므로,
라디칼이다.
( 참고 https://ywpop.tistory.com/3290 )
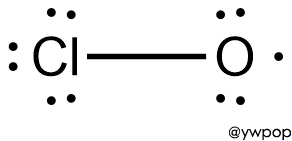
▶ 형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고 https://ywpop.tistory.com/2544 )
> Cl의 형식전하 = 7 – 6 – 1 = 0
> O의 형식전하 = 6 – 5 – 1 = 0
---> 형식전하가 존재하지 않는
안정한 루이스 구조이다.
[참고] ClO 라디칼에서 홀전자가
염소(Cl)가 아닌 산소(O)에 “주로” 존재하는 이유
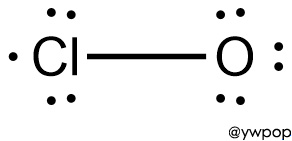
> Cl의 형식전하 = 7 – 5 – 1 = +1
> O의 형식전하 = 6 – 6 – 1 = –1
---> 모든 원자에 형식전하가 존재한다.
---> 염소(Cl)에 홀전자가 존재하는 ClO는
불안정한 루이스 구조이다.
[참고] ClO 라디칼. ClO 분자 라디칼
> ClO 자체는 실험실에서 “병에 담아” 안정적으로 보관할 수 있는 물질은 아니지만, 기체 상태의 ClO 라디칼(chlorine monoxide radical) 형태로는 존재한다.
> ClO 라디칼은 대기 중 할로겐 화학(특히 성층권에서 오존 파괴 과정)에서 중요한 역할을 하는 반응성 화학종이다.
Cl + O3 → ClO + O2
( 참고 https://ywpop.tistory.com/7403 )
[ 관련 글 https://ywpop.tistory.com/470800 ]
ClO^- 루이스 구조 그리기
Lewis structure of ClO^- ion. hypochlorite ion
[키워드] ClO 루이스 구조 기준, ClO 루이스 기준, ClO 분자 루이스 구조 기준, ClO 분자 루이스 기준, ClO 라디칼 루이스 구조 기준, ClO 라디칼 루이스 기준
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 공명 구조. 같은 구조 (9) | 2025.06.14 |
|---|---|
| CH2N2 루이스 구조. 사이안아마이드 cyanamide (3) | 2025.06.13 |
| 수소의 전기음성도는 플루오린과 탄소의 중간에 해당하고, 인과 동일 (2) | 2025.06.10 |
| NO2F 루이스 구조 그리기. nitryl fluoride (2) | 2025.06.09 |
| Lewis structure H2CO H2O2 C2F6 AsO3^3- H2SO3 NH2Cl (0) | 2025.06.01 |
| NH2Cl 루이스 구조. monochloramine (0) | 2025.06.01 |
| AsO3^3- 루이스 구조. arsenite ion (0) | 2025.06.01 |
| C2F6 루이스 구조 (0) | 2025.06.01 |




댓글