철의 제련. 코크스와 석회석. 산화-환원 반응

[ 그림 출처 Wikimedia ] 코크스.
코크스(독일어: Koks, 영어: coke)는 탄소 함량이 높고 불순물은 미량인
연료의 일종이다. 대개 석탄을 원료로 만든다.
코크스(C)는 산화되면 일산화탄소(CO)가 된다.
코크스(C)는 철광석을 금속 철로 환원시키는데 필요한
환원제인 CO를 만들기 위해 넣고,
C + O2 → CO2
CO2 + C → 2CO
( 전체 반응: 2C + O2 → 2CO )
( 참고: redox 전체 반응 https://ywpop.tistory.com/9788 )
( 단, 온도에 따라(저온에서), ... 아래에 나옴
코크스가 환원제 역할을 할 수도 있다. )
석회석(CaCO3)은 철광석에 포함된
불순물(주성분은 SiO2)을 제거하기 위해 넣습니다.
CaCO3 → CaO + CO2
CaO + SiO2(불순물) → CaSiO3
[참고] CaCO3 → CaO + CO2 반응은 산화-환원 반응인가?
[ https://ywpop.tistory.com/10084 ]
▶ 철의 제련
[1] Fe2O3 + 3CO → 2Fe + 3CO2
> 산화되는 물질: CO (탄소의 산화수는 +2에서 +4로 증가)
---> CO는 환원제.
> 환원되는 물질: Fe2O3 (철의 산화수는 +3에서 0으로 감소)
---> Fe2O3는 산화제.
> Fe2O3가 환원될 때 이동한 전자의 몰수는 6 mol.
( 참고: redox Fe2O3 + CO https://ywpop.tistory.com/6261 )
( 참고: 미정계수법 https://ywpop.tistory.com/3902 )

온도에 따라(저온에서), 다음 반응에 의해 철을 얻을 수도 있습니다.
[2] 2Fe2O3 + 3C → 4Fe + 3CO2
( carbon from coke )
[3] Fe3O4 + 4CO → 3Fe + 4CO2
( 참고: redox Fe3O4 + CO https://ywpop.tistory.com/5637 )
---------------------------------------------------
Carbon is more reactive than iron, so it can displace iron from iron(III) oxide:
2Fe2O3(s) + 3C(s) → 4Fe(l) + 3CO2(g)
In the blast furnace, it is so hot that carbon monoxide can be used, in place of carbon, to reduce the iron(III) oxide:
( 온도가 매우 높은 용광로 안에서는, C대신 CO가 산화철(III)을 환원시키는데 사용된다. )
Fe2O3(s) + 3CO(g) → 2Fe(l) + 3CO2(g)
[ 자료 출처: https://www.bbc.com/bitesize/guides/zpcdsg8/revision/4 ]
※ 용광로 내부에서는 Fe(l), 일반적인 반응식에서는 Fe(s)
> 2Fe2O3(s) + 3C(s) → 4Fe(s) + 3CO2(g)
> Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
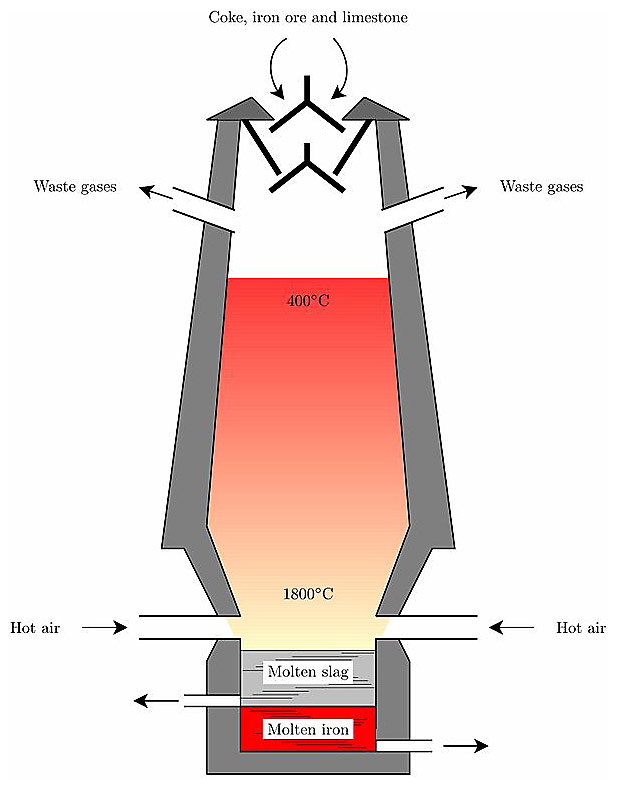
[ 그림 출처 Wikimedia ] 용광로 (blast furnace).
▶ 용광로 중층부 (400~900 ℃)
> FeO + CO → Fe + CO2
> Fe2O3 + CO → 2FeO + CO2
> Fe3O4 + CO → 3FeO + CO2
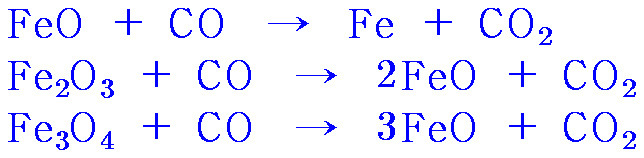
▶ 용광로 하층부 (900~1900 ℃)
> FeO + C → Fe + CO
> Fe2O3 + C → 2FeO + CO
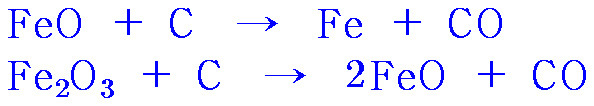
[참고] 철광석의 제련은 발열 과정이다.
Smelting of iron ore is an exothermic process.
Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g) ... ΔH° = –24.8 kJ
[ 관련 예제 https://ywpop.tistory.com/21312 ]
[키워드] 철의 제련 기준, 철의 제련 사전, 산화철의 환원 기준, 산화철의 환원 사전
[Google 검색 실적] 2024년 8월 인기 상승 페이지
'화학' 카테고리의 다른 글
| 결합엔탈피로 반응엔탈피 계산. 2H2 + O2 → 2H2O (1) | 2015.11.30 |
|---|---|
| 중화열 측정. CsOH(aq) + HCl(aq) (0) | 2015.11.29 |
| 2NO(g) + O2(g) → N2O4(g) 반응에 대한 ΔH°(kJ) (0) | 2015.11.29 |
| 수은 압력계(mercury manometer)로 측정한 기체의 압력 (2) | 2015.11.29 |
| 다원자 이온, 원자단의 명명법 (0) | 2015.11.29 |
| 2.50 g HCl이 용해된 890 mL 용액의 농도와 pH (0) | 2015.11.29 |
| 증류수에 탄산칼슘을 넣었을 때 이산화탄소가 발생할 수 있나요 (0) | 2015.11.29 |
| 유기화합물 명명법. 벤젠 치환기 (0) | 2015.11.28 |

댓글