이상기체와 실제기체. 25℃, 10 L, 0.5 mol N2의 압력
실제기체 방정식. van der Waals equation
25℃에서 10.00 L 용기에 들어있는 0.5000 mol N2가 가하는 압력을 계산하라.
a. 이상 기체 방정식으로 계산
b. van der Waals 방정식으로 계산
c. 두 결과를 비교하라.
Calculate the pressure exerted by 0.5000 mol N2 in a 10.00 L container at 25℃.
a. using the ideal gas law
b. using the van der Waals equation
c. Compare the results.
a. 이상기체 방정식으로 계산한 압력
PV = nRT
( 참고 https://ywpop.tistory.com/3097 )
P = nRT / V
= (0.5000 mol) (0.08206 atm•L/mol•K) (300.15 K) / (10.00 L)
= 1.232 atm
b. van der Waals equation으로 계산한 압력
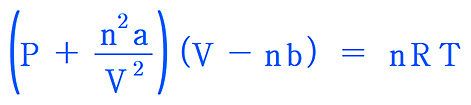
> 질소의 van der Waals 상수: a = 1.39, b = 0.0391
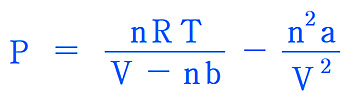
P = [nRT / (V – nb)] – [n^2 a / V^2]
( 참고 https://ywpop.tistory.com/7254 )
= [0.5000×0.08206×300.15 / (10.00 – 0.5000×0.0391)]
– [0.5000^2×1.39 / 10.00^2]
= 1.230 atm
c. ① 이상기체의 압력 > 실제기체의 압력
---> 예상 결과와 같다.
( 참고 https://ywpop.tistory.com/24577 )
② 압력 차이가 거의 없으므로, 주어진 조건 하에서,
실제 기체는 이상 기체처럼 행동한다는 것을 알 수 있다.
[키워드] 실제기체의 압력 기준
'일반화학 > [10장] 기체' 카테고리의 다른 글
| H2보다 2.92배 느리게 확산되는 기체의 몰질량 (0) | 2015.11.24 |
|---|---|
| STP 1.00×10^5 L CH4 몇 mol 몇 g (0) | 2015.10.21 |
| 기체의 온도와 압력 관계. 기체 분자 운동론 (1) | 2015.07.12 |
| 기체 분자 운동론의 가정 ★ (2) | 2015.06.26 |
| 2.00 L H2 475 torr + 1.00 L N2 0.200 atm ★ (1) | 2015.06.12 |
| 기체 분자의 평균 운동 에너지, average kinetic energy (2) | 2015.06.11 |
| 273 K 546 K에서 CH4 N2의 제곱근-평균-제곱속도 (0) | 2015.06.11 |
| 3.0 atm HN3의 분해. N2 H2 분압과 전체 압력 (0) | 2015.06.10 |


댓글