알칼리 금속과 물의 반응. Alkali Metal-Water Reactions
---------------------------------------------------
▶ 참고: 제7장 원소의 주기적 성질. 목차
[ https://ywpop.tistory.com/15245 ]
---------------------------------------------------
▶ 알칼리 금속의 반응성은
족의 아래로 내려갈수록 증가한다. 즉,
Li < Na < K < Rb < Cs 순으로 증가.
The reactivities of the alkali metals
increase going down the group.
▶ 족의 아래로 내려갈수록,
알칼리 금속의 1차 이온화 에너지 및
원자화 에너지(= 승화 에너지)는 감소하며,
이 때문에 알칼리 금속의 반응성은 증가한다.
( 참고: 이온화 에너지의 경향성 https://ywpop.tistory.com/10684 )
This is the result of a combination of two factors:
the first ionisation energies and
atomisation energies(= sublimation enthalpies) of the alkali metals.
This quantity decreases going down the group,
and so does the activation energy;
thus, chemical reactions can occur faster and
the reactivity increases down the group.
---------------------------------------------------
▶ 모든 알칼리 금속은
찬 물(cold water)과 격렬하게 또는 폭발적으로 반응한다.
All the alkali metals react vigorously or explosively with cold water,
producing an aqueous solution of a strongly basic alkali metal hydroxide
and releasing hydrogen gas.
▶ 알칼리 금속과 물이 반응하면,
강염기인 수산화물이 생성된다.
> 1족 금속을 “알칼리(alkali) 금속”,
2족 금속을 “알칼리 토금속”이라 부르는 이유.
> “알칼리 = 염기성”이므로, “알칼리 금속 = 염기성 금속”.
> 친절하게도, 헷갈리지 말라고, 아예 이름을 알칼리 금속이라고 부르잖아.
> 즉, 이들 금속은 본질적으로(태생적으로) 염기성이다.
( Notice the group of metals itself is called Alkali metals
meaning they are basic in nature. )
( 참고: 염기성 산화물 https://ywpop.tistory.com/6840 )
▶ 알칼리 금속(M)과 물의 반응식
2M(s) + 2H2O(l) → 2MOH(aq) + H2(g)
예) 나트륨 금속의 경우,
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
Na(s) + H2O(l) → NaOH(aq) + H ... (×)
---> 수소는 H 원자 상태가 아닌 H2 분자 상태로 존재.
▶ 알칼리 금속이 염기성 물질인 이유
분자 반응식
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
완전 이온 반응식
2Na(s) + 2H2O(l) → 2Na^+(aq) + 2OH^-(aq) + H2(g)
---> 물에서 OH^- 이온을 내놓기 때문에, 염기성 물질이다.
( 참고: 산-염기의 정의 https://ywpop.tistory.com/2696 )
2K(s) + 2H2O(l) → 2KOH(aq) + H2(g)
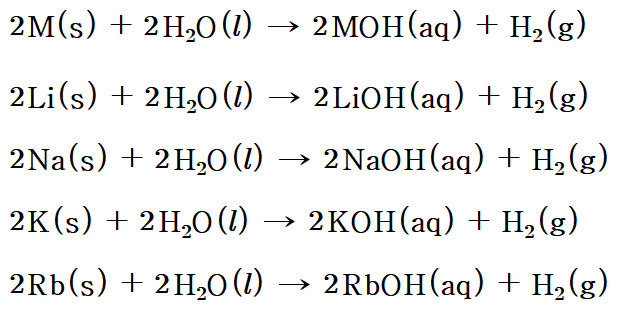
> 이 반응은 매우 빠르며, 또한 열이 발생하는 발열반응이다.
> 이 때문에 생성된 수소가 연소되어 불꽃이 튀기도 한다.
( 모든 알칼리 금속은 기름 속에 보관하기 때문에,
연소 가능한 소량의 기름이 존재한다. )
> 만약 페놀프탈레인 지시약을 미리 가해 둔 물에 알칼리 금속을 넣었다면,
수용액의 색깔은 염기성을 나타내는 붉은 분홍색으로 변한다.
NaOH(aq) → Na^+(aq) + OH^-(aq)
프랑슘(francium, Fr)은
반감기가 22분으로 매우 짧은(불안정한) 방사성 원소이기 때문에,
프랑슘을 직접 물에 넣어 반응시켜 본 사람은 아직 없다.
그러나 프랑슘과 물의 반응을 상상하면,
그것은 원자폭탄의 폭발과 같은 모습일 것이다.
> 이 반응은 족의 아래로 내려갈수록 더 격렬해진다. 즉,
Li < Na < K < Rb < Cs 순으로 증가한다.
This reaction becomes more vigorous going down the group:
lithium reacts steadily with effervescence,
but sodium and potassium can ignite and
rubidium and caesium(cesium) sink in water
and generate hydrogen gas so rapidly
that shock waves form in the water
that may shatter glass containers.
▶ 족의 아래로 내려갈수록,
물에 대한 1족 금속의 반응성은 증가한다.
The Group 1 metals become more reactive
towards water down the group.
[ 자료 출처 chem.libretexts.org ]

[ 그림 출처 commons.wikimedia.org ] 기름(oil) 속에 보관중인 금속 나트륨(Na) 원소.
[참고] 알칼리 금속과 산소의 반응
Reactions of alkali metals with oxygen
> 4Li(s) + O2(g) → 2Li2O(s)
> 4Na(s) + O2(g) → 2Na2O(s)
> 4K(s) + O2(g) → 2K2O(s)

[ 관련 글 https://ywpop.tistory.com/9680 ] 공기 중 나트륨 금속의 반응
[ 관련 글 https://ywpop.tistory.com/23659 ] 알칼리 금속이 물, 산소와 쉽게 잘 반응하는 이유

[그림] 주기율표. 알칼리 금속과 알칼리 토금속.
[ 관련 글 https://ywpop.tistory.com/14259 ] 알칼리 토금속과 물의 반응
[ 관련 글 https://ywpop.tistory.com/3844 ] 텐진 폭발 원인, 탄화칼슘, CaC2
[키워드] 나트륨과 물 기준, 나트륨과 물의 반응 기준, 알칼리금속과 물 기준, 알칼리금속과 물의 반응 기준, Na + H2O 기준문서, 나트륨의 보관 기준, 나트륨 보관 기준, 알칼리금속의 보관 기준, 알칼리금속 기준, 알칼리금속 사전
'일반화학 > [07장] 원소의 주기적 성질' 카테고리의 다른 글
| 등전자성 이온들의 이온 반지름. 핵전하 (0) | 2016.12.22 |
|---|---|
| 주기율표 족 명칭 방법 ★ (0) | 2016.10.04 |
| 동소체. allotrope ★ (1) | 2016.09.08 |
| 모든 원소의 전자 친화도(electron affinity)는 항상 +값일까? (4) | 2016.08.18 |
| 비활성 기체. noble gas atom? noble gas molecule? (1) | 2016.03.11 |
| 원자의 이온의 크기 ★ (0) | 2015.12.04 |
| 주기율표와 원소의 주기적 경향(성질). 이온화 에너지 (0) | 2015.11.16 |
| 알칼리 금속 화합물의 불꽃 반응, Flame test (0) | 2014.11.18 |



댓글