탄산과 탄산염의 이온화 반응식
가용성 염의 이온화 반응식
---------------------------------------------------
[1] 탄산의 이온화 반응식
> H2CO3의 이온화 반응식
[1단계] H2CO3(aq) ⇌ H^+(aq) + HCO3^-(aq)
[2단계] HCO3^-(aq) ⇌ H^+(aq) + CO3^2-(aq)
[전체] H2CO3(aq) ⇌ 2H^+(aq) + CO3^2-(aq)
( 참고 https://ywpop.tistory.com/7096 )
> 탄산은 2가 산이므로, 2단계로 이온화되며,
이온화 결과 생성된 각각의 음이온은
금속 양이온과 결합하여 탄산염을 형성할 수 있다.
> HCO3^-(aq) + Na^+(aq) →(가열/건조)→ NaHCO3(s)
> CO3^2-(aq) + 2Na^+(aq) →(가열/건조)→ Na2CO3(s)
> 탄산 이온, CO3^2-는 원자단이므로,
더 이상 이온화되지 않는다.
( 참고: 원자단 https://ywpop.tistory.com/2968 )

[2] 탄산수소나트륨의 이온화 반응식
> NaHCO3의 이온화 반응식
NaHCO3(aq) → Na^+(aq) + HCO3^-(aq)
( 참고 https://ywpop.tistory.com/7764 )

[3] 탄산나트륨의 이온화 반응식
> Na2CO3의 이온화 반응식
Na2CO3(aq) → 2Na^+(aq) + CO3^2-(aq)
( 참고 https://ywpop.tistory.com/11140 )

[4] 탄산칼슘의 이온화 반응식
> CaCO3의 이온화 반응식
CaCO3(aq) → Ca^2+(aq) + CO3^2-(aq)
( 참고 https://ywpop.tistory.com/22756 )
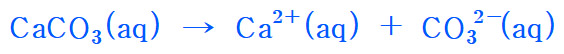
[ 관련 글 https://ywpop.tistory.com/7156 ] 이온 결합 화합물 화학식 쓰기
---> 이온화 반응식을 이해하는데 도움이 된다.
[ 관련 글 https://ywpop.tistory.com/15455 ] CO3^2-가 –2인 이유
[키워드] 탄산 루이스 구조 기준문서, 탄산수소나트륨 루이스 구조 기준문서, 탄산나트륨 루이스 구조 기준문서, 탄산 사전
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 96.000 mL 0.500 M CaCl2(aq) 160.00 mL 0.400 M Na3PO4(aq) (0) | 2022.12.08 |
|---|---|
| 191.00 mL 0.300 M CaCl2(aq) 150.00 mL 0.400 M Na3PO4(aq) (0) | 2022.12.08 |
| 산-염기 반응이 아닌 것. CO2 + H2O ⇌ H2CO3 (0) | 2022.12.07 |
| 산과 염기의 반응 과정 (0) | 2022.12.06 |
| 탄산칼슘의 이온화. CaCO3의 이온화 (0) | 2022.12.02 |
| 산화된 물질과 환원된 물질을 짝 짓는 방법 (0) | 2022.12.01 |
| redox CH4 + Cl2 → CH3Cl + HCl (0) | 2022.11.28 |
| redox Co + S → CoS (0) | 2022.11.28 |


댓글