PHCl2 루이스 구조 그리기
Lewis structure of PHCl2
---------------------------------------------------
▶ 참고: 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
(P) + (H) + 2(Cl) = (5) + (1) + 2(7) = 20
[2단계] 화합물의 기본 골격 구조를 그린다.
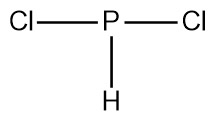
20 – 3(2) = 14
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )
( 단, H는 결합전자 2개로 팔전자 규칙 만족. )

14 – 2(6) = 2
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
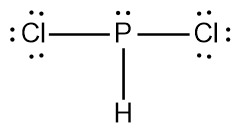
▶ 형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고: 형식전하 https://ywpop.tistory.com/2544 )
> P(2)의 형식전하 = 5 – 2 – (6/2) = 0
( 괄호 안 숫자는 비결합전자수. )
> Cl(6)의 형식전하 = 7 – 6 – (2/2) = 0
> H의 형식전하 = 1 – 0 – (2/2) = 0
---> 형식전하를 가진 원자가 없다.
---> 안정한 루이스 구조.
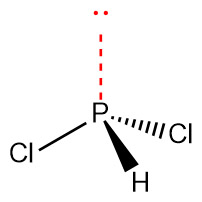
[그림] PHCl2의 기하 구조.
중심 원자 P의 전자 영역 = 4개 이므로,
> P의 혼성 오비탈 = sp^3
> 전자 영역의 기하 구조 = 사면체. tetrahedral
> 분자의 기하 구조 = 삼각뿔. trigonal pyramidal
( 참고 https://ywpop.tistory.com/11542 )
> PHCl2의 기하 구조는 암모니아(NH3)의 기하 구조와 유사하다.
( 참고 https://ywpop.tistory.com/9934 )
[ 관련 글 https://ywpop.tistory.com/2541 ] PCl3 루이스 구조 그리기
[참고] H–Cl–P–Cl 루이스 구조가 안되는 이유
[2단계] H–Cl–P–Cl
20 – 3(2) = 14
[3단계] H–Cl(4)–P–Cl(6)
14 – 10 = 4
[4단계] H–Cl(4)–P(4)–Cl(6)
4 – 4 = 0
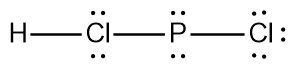
> H의 형식전하 = 1 – 0 – (2/2) = 0
> Cl(4)의 형식전하 = 7 – 4 – (4/2) = +1
> P(4)의 형식전하 = 5 – 4 – (4/2) = –1
> Cl(6)의 형식전하 = 7 – 6 – (2/2) = 0
---> 형식전하를 갖는 원자가 2개 존재.
[키워드] PHCl2 루이스 기준문서
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| CH2F2 루이스 구조. CH2F2 기하 구조 (0) | 2022.10.20 |
|---|---|
| NH3 루이스 구조. NH3 전자-점 구조 (0) | 2022.10.05 |
| 동핵 이원자 분자는 무극성 (0) | 2022.10.02 |
| BF4^- 루이스 구조 그리기 (0) | 2022.09.26 |
| ClO2^- 루이스 구조 그리기 (0) | 2022.09.15 |
| 분자의 화학식으로부터 분자의 기하구조 예측 (1) | 2022.09.07 |
| VSEPR. 메탄올의 결합각 (0) | 2022.09.07 |
| N3^- NO2^- I3^- 루이스 구조 (0) | 2022.08.10 |




댓글