금속의 이온전하(= 산화수) 결정하기
[참고] 주기율표 족 이름 붙이는 방법
① 미국식: 전형원소는 A, 전이원소는 B
② IUPAC: 전형/전이 구분없이 1족~18족
( 참고 https://ywpop.tistory.com/5893 )

[그림] 주기율표와 이온전하.
( 참고 https://ywpop.tistory.com/4841 )
▶ 금속의 이온전하를 암기할 때는
전형원소, 전이원소로 구분하는 것이 도움이 된다.
▶ 1A족 금속의 이온전하 = +1 (항상, 100%, 예외없음)
> 족의 숫자와 이온전하 값이 같다.
예) Na^+, K^+
▶ 2A족 금속의 이온전하 = +2 (항상, 100%, 예외없음)
> 족의 숫자와 이온전하 값이 같다.
예) Mg^2+, Ca^2+
▶ 3A족 금속인 Al의 이온전하 = +3 (항상, 100%, 예외없음)
> 알루미늄의 이온전하만 항상, 100% +3.
▶ 2B족 금속인 Zn의 이온전하 = +2 (99%)
> 이 때문에 어떤 학자는 Zn을 전이금속에서 제외시키기도 함.
▶ 나머지 모든 금속의 이온전하는
화학식이 주어졌을 때, 화학식을 보고,
산화수 구하는 규칙을 이용해서 결정한다.
( 참고: 산화수 구하는 규칙 https://ywpop.tistory.com/2719 )
산화수 구하는 규칙으로 몇 개 전이금속의 이온전하를 결정해보면,
▶ TiO2에서 Ti의 이온전하 = +4
> O의 산화수 = –2 (넘버 3) 이므로,
(Ti) + 2(O) = 0
(Ti) + 2(–2) = 0
> 따라서 Ti의 산화수 = +4.
▶ KMnO4에서 Mn의 이온전화 = +7
( 참고 https://ywpop.tistory.com/9583 )
▶ FeCl3에서 Fe의 이온전하 = +3
> Cl의 산화수 = –1 (넘버 1인 F의 사촌) 이므로,
(Fe) + 3(Cl) = 0
(Fe) + 3(–1) = 0
> 따라서 Fe의 산화수 = +3.

[그림] 루이스 전자 점 기호로 나타낸 주기율표.
( 참고 https://ywpop.tistory.com/2872 )
8족 비활성기체의 전자배치(8개 전자)와 같아지려고,
① 1 ~ 3개의 전자를 가진 금속은 전자를 버린다(버리고 싶어한다).
---> 금속은 +1 ~ +3가의 양이온이 된다.
② 5 ~ 7개의 전자를 가진 비금속은 전자를 얻는다(얻고 싶어한다).
---> 비금속은 –3 ~ –1가의 음이온이 된다.
( 참고: 옥텟 규칙 https://ywpop.tistory.com/2634 )
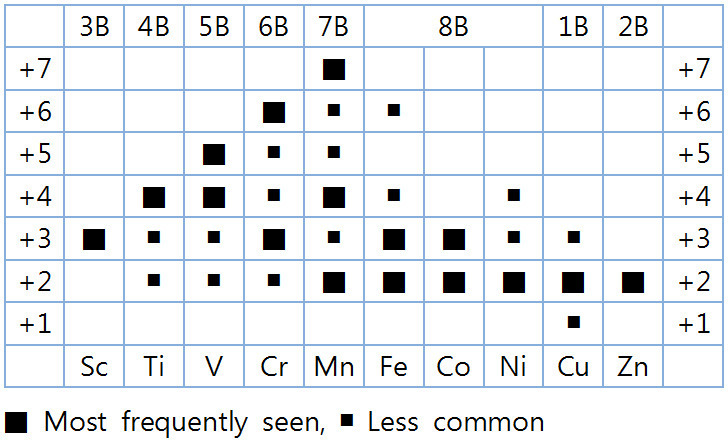
[그림] 전이금속의 산화수. oxidation states of transition metals.
( 참고: 전이금속(3B~2B)의 이온전하 https://ywpop.tistory.com/7346 )
[ 관련 글 https://ywpop.tistory.com/3012 ] 무기화합물 명명법에서 괄호안의 로마숫자
[키워드] 금속의 이온전하 기준문서, 금속의 이온전하 사전, 금속의 산화수 기준문서, 금속의 산화수 사전, 금속의 이온전하 결정 기준문서, 금속의 이온전하 결정 사전, 금속의 산화수 결정 기준문서, 금속의 산화수 결정 사전
'일반화학 > [07장] 원소의 주기적 성질' 카테고리의 다른 글
| 원소기호 이름 규칙 (2) | 2023.02.27 |
|---|---|
| PBr3의 P–Br 결합 길이와 AsCl3의 As–Cl 결합 길이 (2) | 2023.01.05 |
| X–X 결합 길이 2.04 Å Y–Y 결합 길이 1.68 Å X–Y 결합 길이 (0) | 2023.01.04 |
| 리튬의 첫 번째 이온화 에너지가 헬륨보다 현저히 낮은 이유 (0) | 2022.10.09 |
| the largest radius. Cl^- P^3- K^+ S^2- Ar (0) | 2022.09.06 |
| 전자의 에너지 준위와 이온화 에너지 (0) | 2022.06.26 |
| 준금속은 양이온이 되기 쉬울까? 음이온이 되기 쉬울까? (0) | 2022.06.26 |
| 14족 원소의 옥텟규칙 (2) | 2022.06.19 |


댓글