728x170
ΔH 계산. 3N2O4(g) + 2H2O(l) → 4HNO3(aq) + 2NO(g)
생성엔탈피로 반응엔탈피 계산
Given the standard heats of formation
shown in Appendix B in your textbook,
What is ΔH° in kJ for the reaction
3N2O4(g) + 2H2O(l) → 4HNO3(aq) + 2NO(g)
---------------------------------------------------
▶ 참고: 생성엔탈피로 반응엔탈피 계산
[ https://ywpop.tistory.com/3431 ]
---------------------------------------------------
ΔH°_rxn = [생성물들의 ΔH°_f 합] – [반응물들의 ΔH°_f 합]
= [4(HNO3,aq) + 2(NO,g)] – [3(N2O4,g) + 2(H2O,l)]
= [4(–207) + 2(90)] – [3(10) + 2(–286)]
= –106 kJ
또는
[4(–207.4) + 2(95.4)] – [3(11.1) + 2(–285.8)]
= –100.5 kJ
[참고] 문제에서 각 물질의 표준생성엔탈피 값이 주어지지 않았기에,
참고하는 문헌값에 따라 정답의 숫자는 약간 차이날 수 있다.
[표] 질소 화합물의 표준 생성 엔탈피
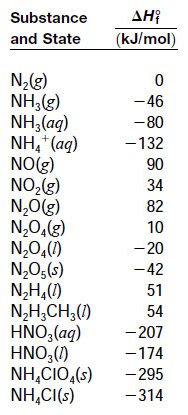
[ 출처: 줌달 일반화학 8판 ]
반응형
그리드형(광고전용)
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 298 K 1 atm Ba 2.740 g BaO 11.14 kJ ΔH°_f (0) | 2022.05.26 |
|---|---|
| 23℃ 361 g 0℃ ice 334 J (0) | 2022.05.26 |
| LiCl(s) ΔH = –36.9 kJ 25.0 g LiCl 125 mL water 25.0℃ (0) | 2022.05.26 |
| ethanol ΔH° = –555 kJ/mol 125.0 g (0) | 2022.05.24 |
| S(s) + O2(g) → SO2(g) ΔH = –296 kJ/mol (0) | 2022.05.24 |
| ΔE 계산. q = –47 kJ, w = +88 kJ (0) | 2022.05.23 |
| 25.0 g ethanol –135℃ to –60℃ (kJ) (0) | 2022.05.23 |
| 프로페인 연소반응. C3H8(g) ΔH = –2221 kJ 60.% C3H8 mass (0) | 2022.05.21 |
댓글