NO2 루이스 구조 그리기. 이산화질소
Lewis structure of NO2. nitrogen dioxide
---------------------------------------------------
▶ 참고: 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
NO2 = (5) + 2(6) = 17
[2단계] 화합물의 기본 골격 구조를 그린다.
( 단일결합 수만큼 전자 수를 뺀다. )
O–N–O
17 – 2(2) = 13
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )
( 그린 전자 수만큼 뺀다. )
O(6)–N–O(6)
( 참고: 원자 다음 괄호안 숫자는 그 원자의 비공유전자의 개수 )
13 – 2(6) = 1
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
중심 원자도 팔전자 규칙에 맞나? Yes → Stop.
중심 원자도 팔전자 규칙에 맞나? No → 3단계에서 남은 원자가전자가 있나?
① Yes → 중심 원자에 전자 한 쌍씩 그린다, 모두 사용할 때까지.
O(6)–N(1)–O(6)
② No → 주위 원자의 비결합전자쌍을 사용하여 이중 또는 삼중 결합을 그린다,
중심 원자도 팔전자 규칙에 맞을 때까지.
O(4)=N(1)=O(4)
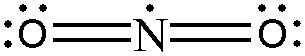

▶ NO2의 루이스 구조식에서,
각 단일 결합은 공유 전자쌍 1개를 의미하고,
각 공유 전자쌍은 결합에 참여한 양쪽 원자가 1개씩 제공한 것이다.
---> 산소(O)의 원자가전자는 6개, 주위 전자는 8개. 옥텟 규칙 만족.
---> 질소(N)의 원자가전자는 5개, 주위 전자는 9개. 옥텟 규칙 불만족.
▶ NO2에서 질소(N) 원자는 9개의 전자를 가진다.
---> N은 2주기 원소이므로 옥텟(8전자)을 초과할 수 없다.
▶ 공명 구조를 갖는 NO2의 실제 루이스 구조
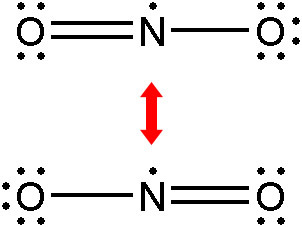
형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고 https://ywpop.tistory.com/2544 )
> N의 형식전하 = 5 – 1 – (3) = +1
> O(단일결합)의 형식전하 = 6 – 6 – (1) = –1
> O(이중결합)의 형식전하 = 6 – 4 – (2) = 0

[그림] NO2 분자의 기하 구조는 굽은형.
---> NO2는 극성 분자 (polar molecule).
[ 관련 글 https://ywpop.tistory.com/2832 ] NO2 NO2^+ NO2^- NO의 루이스 구조식
[ 참고 https://ywpop.tistory.com/8577 ] 옥텟 규칙의 예외
[참고] 불가능한 NO2 루이스 구조
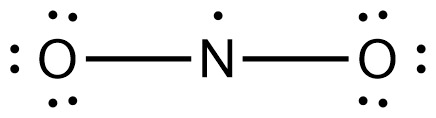
> N의 형식전하 = 5 – 1 – (2) = +2
> O의 형식전하 = 6 – 6 – (1) = –1
---> 모든 원자에 형식전하가 할당된다.
---> 불안정한 루이스 구조.
---> 이런 루이스 구조는 존재할 수 없다.
[키워드] 옥텟 규칙 예외 기준문서, 옥텟 예외 기준문서, 옥텟 규칙의 예외 기준문서, 팔전자 규칙의 예외 기준문서, 옥텟 룰의 예외 기준문서, NO2 루이스 기준문서, NO2 루이스 구조 기준문서
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 화학결합의 원리. 원자가 원소 화합물이 되는 이유 (0) | 2019.05.04 |
|---|---|
| TiCl4는 공유결합 화합물 (1) | 2019.03.25 |
| AlCl3는 공유결합 화합물. AlCl3 ionic or covalent (0) | 2019.03.06 |
| 물 분자. H2O molecule (1) | 2019.01.26 |
| H3O^+의 루이스 구조와 형식 전하 (1) | 2018.11.26 |
| 단일결합과 다중결합의 평균 결합 길이 (0) | 2018.11.16 |
| SF4 루이스 구조 그리기. SeF4 루이스 구조 그리기 (1) | 2018.10.20 |
| 왜 NH4^+는 양이온이고 BH4^-는 음이온인가? (1) | 2018.10.08 |




댓글