SO2 루이스 구조 그리기 (추가자료)
[참고] SO2 루이스 구조 그리기
[ https://ywpop.tistory.com/3595 ]
에 이어지는 글입니다.
실험으로 증명된 실제 SO2의 구조는
공명 구조를 갖는 아래와 같은 구조이지만,
형식 전하도 공부할 겸, SO2의 형식 전하를 계산해보니,
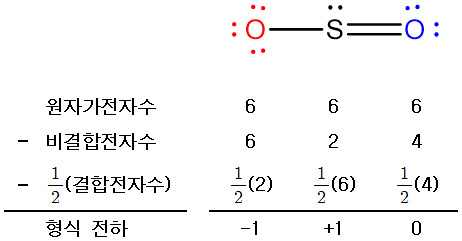
1개 산소 원자에 –1, 황 원자에 +1의 형식 전하가 할당된다.
모든 원자들이 0에 가까운 형식 전하를 갖는 구조가 더 안정하고,
또한 황은 다음과 같은 경우에 해당되기 때문에,
① 중심 원자가 3주기 이상 원자이고, and,
② 형식 전하를 없앨 수 있다면,
---> 팔전자(옥텟규칙)를 초과할 수 있다.
---> 확장 팔전자 규칙 또는 18 전자 규칙
( 참고: SOCl2의 루이스 구조 https://ywpop.tistory.com/3754 )
SO2는 다음과 같은 두 번째 루이스 구조를 가질 수 있다.
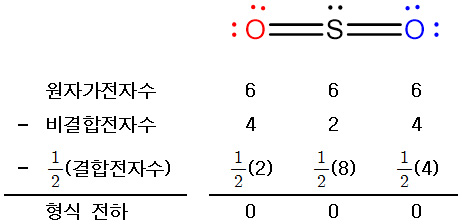
위 구조에서는 모든 원자들의 형식 전하가 0(영)이므로,
이론적으로는 공명 구조를 갖는 첫 번째 구조보다
더 안정한 루이스 구조이다.
정리하면,
이론적으로는, 또는, 형식 전하만 고려하면,
모든 원자들의 형식 전하가 0인 두 번째 구조가 더 안정한 구조이지만,
SO2의 실험 자료는
공명 구조를 갖는 첫 번째 구조를 가리키고 있다는 것이다.
결론을 내리면,
실제 SO2의 구조는 첫 번째 구조(O–S=O)이며,
이는 공명 구조에 의한 안정화 효과가
형식 전하를 갖는다는 불안정한 요소를
극복하게 만들었다고 생각할 수 있다.
[키워드] SO2 루이스 기준, SO2 루이스 구조 기준, 형식전하 예외 기준, 형식전하 예외 사전, 형식전하 보다 기준, 형식전하 보다 공명 구조 기준
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| H3O^+의 루이스 구조와 형식 전하 (1) | 2018.11.26 |
|---|---|
| 단일결합과 다중결합의 평균 결합 길이 (0) | 2018.11.16 |
| SF4 루이스 구조 그리기. SeF4 루이스 구조 그리기 (1) | 2018.10.20 |
| 왜 NH4^+는 양이온이고 BH4^-는 음이온인가? (1) | 2018.10.08 |
| 격자에너지. MgF2 CaF2 ZrO2 (0) | 2018.06.04 |
| 브로민 원자간의 화학 결합을 깨는데 필요한 빛의 파장 (0) | 2018.05.24 |
| CsF의 격자에너지. 생성엔탈피 계산 (2) | 2018.05.18 |
| 격자에너지. LiCl KCl KBr MgCl2 (2) | 2018.05.16 |


댓글