원자의 구조. 원자의 구성 입자
[1] 음극선과 전자
> 1897년 Thomson, 음극선 실험으로 전자(electron) 발견
( 참고: 음극선 실험 https://ywpop.tistory.com/7031 )
> 1909년 Millikan, 기름방울 실험으로 전자의 전하량 및 질량 계산
[2] 방사능
> 1896년 Becquerel, 우라늄 화합물에서
자발적 방사선 방출, 즉 방사능(radioactivity) 발견
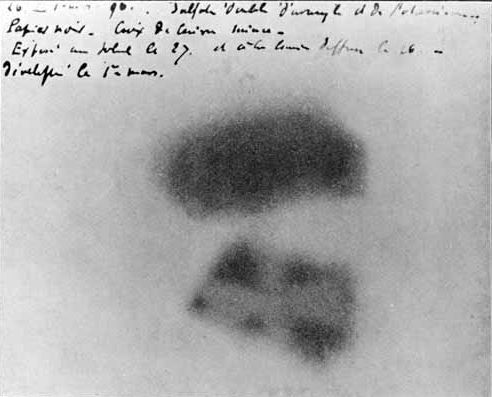
[그림] 방사선에 의해 검게 변한 사진 건판.
( 참고 https://en.wikipedia.org/wiki/Henri_Becquerel )
프랑스 물리학자인 베크렐은 방사선을 발견한 공로로
1903년에 노벨 물리학상을 받았다.
( 참고 ko.wikipedia.org )
> 1899년 Ernest Rutherford와 Paul Villard, 방사선을 3종류로 분리(분류)
> 1907년 Ernest Rutherford와 Thomas Royds,
α 입자가 헬륨 ion이라는 것을 증명
( 참고 https://ywpop.tistory.com/3678 )
[3] 원자핵 모형
>1910년 Rutherford, α(알파) 입자 산란 실험으로 원자핵 모형 제안
( 참고: 원자핵 발견 https://ywpop.tistory.com/11606 )
> 1919년 Rutherford, 양성자(proton) 발견
> 1932년 Chadwick, 중성자(neutron) 발견
( 참고: 양성자와 중성자의 발견 https://ywpop.tistory.com/9086 )

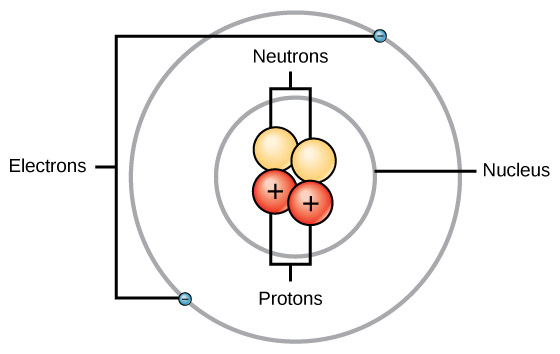
[ 그림 출처 Wikimedia ] 헬륨(He) 원자의 구조.
> 양성자의 개수 + 중성자의 개수 = 질량수 = 4
> 양성자의 개수 = 전자의 개수 = 원자번호 = 2

> 질량수 – 원자번호 = 4 – 2 = 2 = 중성자의 개수
( 참고: 원소기호 표기법 https://ywpop.tistory.com/6994 )
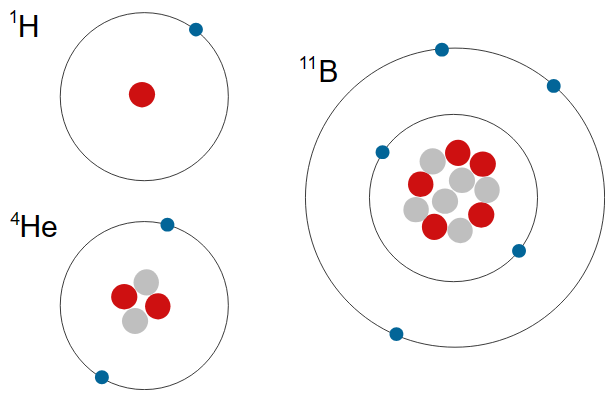
[그림] 수소(H), 헬륨(He), 붕소(B) 원자의 구조.
[ 그림 출처 https://denstoredanske.lex.dk/atom ]
[4] 원자의 구성 입자

양성자의 상대 질량비 = 양성자의 질량 / 전자의 질량
= [1.673×10^(-24) g] / [9.109×10^(-28) g]
= 1837
( 전자의 정확한 질량 = 9.109 383 56×10^(-31) kg )
양성자의 질량 : 전자의 질량
= 1.673×10^(-24) g : 9.109×10^(-28) g
= 1.673×10^(-24) / 9.109×10^(-28) : 9.109×10^(-28) / 9.109×10^(-28)
= 1837 : 1

[주목] 양성자와 중성자의 정확한 질량은 서로 다르다.
중성자의 질량이 아주 조금 더 무겁다.
[ 관련 글 https://ywpop.tistory.com/11587 ] 핵반응 시 질량수는 보존되나, 질량은 보존되지 않는다?
[참고] 전자의 질량은 무시
전자의 질량은
원자핵(양성자+중성자)의 질량에 비해
너무나 작기 때문에,
전자의 질량은 무시한다.
예1) Na 원자의 질량 = Na^+ 이온의 질량
예2) Cl 원자의 질량 = Cl^- 이온의 질량
원자보다 더 작은 입자를 정리하면,
> 원자의 구성 입자 = 양성자 + 중성자 + 전자
> 양성자, 중성자의 구성입자 = 쿼크 + 글루온
[ 관련 글 https://ywpop.tistory.com/7455 ] 쿼크와 글루온
[ 관련 글 https://ywpop.tistory.com/8121 ] 양성자와 양전자
[키워드] 구성 입자의 발견, 전자 발견 기준문서, 양성자 발견 기준문서, 원자의 구조 기준문서, 원자핵의 구조 기준문서, 전자 발견 사전, 양성자 발견 사전, 원자의 구조 사전, 원자핵의 구조 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 한 벌의 양자수. a set of quantum numbers ★ (3) | 2014.10.29 |
|---|---|
| 양자(quantum)와 양자 역학(quantum mechnics)에 대한 짧은 개념 (1) | 2014.10.25 |
| 오비탈의 축퇴, degenerate orbital (0) | 2014.10.24 |
| 원자 오비탈의 전자 배치 순서의 예외, 크롬(Cr)과 구리(Cu) ★ (7) | 2014.10.03 |
| (n+l) 규칙. 원자 오비탈의 에너지 준위, 전자 배치 순서 ★ (2) | 2014.10.02 |
| 원자 오비탈에 전자를 채우는 방법 (전자 배치 순서) ★ (7) | 2014.10.01 |
| 문턱. threshold (0) | 2013.04.08 |
| 파울리 배타 원리(배타율). Pauli exclusion principle ★ (0) | 2012.11.22 |




댓글