1.248 g 1.035 M HCl 30.00 mL 1.010 M NaOH 11.56 mL CaCO3 mass percent
석회석 1.248 g을 분쇄하여 1.035 M HCl 용액 30.00 mL에 녹인다. 과량의 산을 중화시키기 위해 1.010 M NaOH 11.56 mL가 필요하다. 시료 중 HCl 용액과 반응하는 유일한 물질로 추정되는 탄산칼슘의 질량백분율을 계산하시오.
A 1.248 g sample of limestone rock is pulverized and then treated with 30.00 mL of 1.035 M HCl solution. The excess acid then requires 11.56 mL of 1.010 M NaOH for neutralization. Calculate the percent by mass of calcium carbonate in the rock, assuming that it is the only substance reacting with the HCl solution.
---------------------------------------------------
1.035 M HCl 30.00 mL에 들어있는 HCl의 몰수를 계산하면,
(1.035 mol/L) (30.00/1000 L) = 0.03105 mol HCl
( 참고 https://ywpop.tistory.com/7787 )
---> 이 몰수 중에서, 일정량의 HCl이 먼저 CaCO3와 반응하고,
이 반응에서 남은 HCl이 다시 NaOH와 반응한 것이다.
1.010 M NaOH 11.56 mL에 들어있는 NaOH의 몰수를 계산하면,
(1.010 mol/L) (11.56/1000 L) = 0.01168 mol NaOH
HCl + NaOH → NaCl + H2O
HCl : NaOH = 1 : 1 계수비(= 몰수비) 이므로,
즉, HCl : NaOH = 1 : 1 반응하므로,
0.01168 mol NaOH와 반응하고 남아있는 HCl의 몰수를 계산하면,
0.03105 – 0.01168 = 0.01937 mol HCl
---> 즉, 이 몰수만큼 탄산칼슘과 반응했었다.
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CaCO3 : HCl = 1 : 2 반응하므로,
0.01937 mol HCl과 반응한 CaCO3의 몰수를 계산하면,
CaCO3 : HCl = 1 : 2 = ? mol : 0.01937 mol
? = 0.01937 / 2 = 0.009685 mol CaCO3
CaCO3의 몰질량 = 100.09 g/mol 이므로,
0.009685 mol CaCO3의 질량을 계산하면,
0.009685 mol × (100.09 g/mol) = 0.9694 g CaCO3
( 참고 https://ywpop.tistory.com/7738 )
석회석 1.248 g에 들어있는
탄산칼슘의 질량백분율을 계산하면,
% CaCO3 = (0.9694 g / 1.248 g) × 100 = 77.68%
답: 77.68%
[FAQ] [①23/05/16]
'일반화학 > [03장] 화학량론' 카테고리의 다른 글
| 아보가드로와 아보가드로수 (0) | 2017.09.21 |
|---|---|
| 알코올 연소 반응. alcohol combustion (0) | 2017.07.02 |
| 탄화수소 연소 반응. hydrocarbon combustion ★ (0) | 2017.07.02 |
| 철의 제련. 160 g 산화철을 충분한 양의 일산화탄소와 반응 (0) | 2017.06.13 |
| balanced chemical equation. 균형 맞춘 화학 반응식 (0) | 2017.05.20 |
| 몰질량의 개념. 몰질량의 정의, 몰질량 설명 ★ (0) | 2017.05.14 |
| 화학식량과 실험식량 ★ (0) | 2017.04.22 |
| 화학량론. 무게 3.045 g인 구리 동전. copper penny weighing 3.045 g (0) | 2017.04.12 |

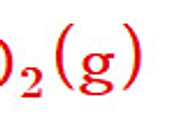

댓글