탄화수소 연소 반응. hydrocarbon combustion
▶ 일반적인 화학 반응식
CxHy + (x + y/4) O2 → x CO2 + y/2 H2O
( 참고 https://ywpop.tistory.com/17026 )
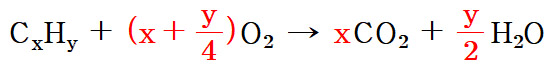

1. 메탄 연소 반응. 메테인 연소. combustion of methane, CH4
CH4 + O2 → CO2 + H2O
CH4 + (1 + 4/4) O2 → CO2 + 4/2 H2O
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
CH4 + 2O2 → CO2 + 2H2O
( CH4의 몰질량 = 16.04 g/mol ≒ 16 g/mol )
( O2의 몰질량 = 32.00 g/mol ≒ 32 g/mol )
( CO2의 몰질량 = 44.01 g/mol ≒ 44 g/mol )
( H2O의 몰질량 = 18.015 g/mol ≒ 18 g/mol )
( 참고: 미정계수법 CH4 + O2 https://ywpop.tistory.com/15183 )
2. 에탄 연소 반응. 에테인 연소. combustion of ethane, C2H6
C2H6 + O2 → CO2 + H2O
C2H6 + (2 + 6/4) O2 → 2 CO2 + 6/2 H2O
C2H6 + 7/2 O2 → 2CO2 + 3H2O
2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(l)
2C2H6 + 7O2 → 4CO2 + 6H2O
( C2H6의 몰질량 = 30.07 g/mol ≒ 30 g/mol )
( 참고: 미정계수법 C2H6 + O2 https://ywpop.tistory.com/20631 )
3. 프로판 연소 반응. 프로페인 연소. combustion of propane, C3H8
C3H8 + O2 → CO2 + H2O
C3H8 + (3 + 8/4) O2 → 3 CO2 + 8/2 H2O
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
C3H8 + 5O2 → 3CO2 + 4H2O
( C3H8의 몰질량 = 44.10 g/mol ≒ 44 g/mol )
( 참고: 미정계수법 C3H8 + O2 https://ywpop.tistory.com/5791 )
4. 부탄 연소 반응. 뷰테인 연소. combustion of butane, C4H10
C4H10 + O2 → CO2 + H2O
C4H10 + (4 + 10/4) O2 → 4 CO2 + 10/2 H2O
C4H10 + 13/2 O2 → 4CO2 + 5H2O
2C4H10(g) + 13O2(g) → 8CO2(g) + 10H2O(l)
2C4H10 + 13O2 → 8CO2 + 10H2O
( C4H10의 몰질량 = 58.12 g/mol ≒ 58 g/mol )
( 참고: 미정계수법 C4H10 + O2 https://ywpop.tistory.com/4542 )
5. 펜탄 연소 반응. 펜테인 연소. combustion of pentane, C5H12
C5H12 + O2 → CO2 + H2O
C5H12 + (5 + 12/4) O2 → 5 CO2 + 12/2 H2O
C5H12(l) + 8O2(g) → 5CO2(g) + 6H2O(l)
C5H12 + 8O2 → 5CO2 + 6H2O
( C5H12의 몰질량 = 72.15 g/mol ≒ 72 g/mol )
※ 불포화 탄화수소도 가능
에틸렌 연소 반응식
C2H4 + O2 → CO2 + H2O
C2H4 + (2 + 4/4) O2 → 2 CO2 + 4/2 H2O
C2H4 + 3O2 → 2CO2 + 2H2O
아세틸렌 연소 반응식
C2H2 + O2 → CO2 + H2O
C2H2 + (2 + 2/4) O2 → 2 CO2 + 2/2 H2O
C2H2 + 5/2 O2 → 2CO2 + H2O
2C2H2 + 5O2 → 4CO2 + 2H2O
벤젠 연소 반응식
C6H6 + O2 → CO2 + H2O
C6H6 + (6 + 6/4) O2 → 6CO2 + 6/2 H2O
C6H6 + 30/4 O2 → 6CO2 + 3H2O
C6H6 + 15/2 O2 → 6CO2 + 3H2O
2C6H6 + 15O2 → 12CO2 + 6H2O
▶ 탄화수소의 연소 반응식 공식이 있지만,
미정계수법을 익히면, 공식을 외울 필요는 없다.
( 참고: 미정계수법 https://ywpop.tistory.com/3902 )
[참고] 탄화수소의 불완전 연소 생성물은 CO와 H2O이다.
[ 관련 글 https://ywpop.tistory.com/11595 ] 메탄의 불완전 연소 반응식
[ 관련 글 https://ywpop.tistory.com/7442 ] 알코올의 연소 반응
[ 관련 글 https://ywpop.tistory.com/22103 ] CHO 연소 반응식
[ 관련 글 https://ywpop.tistory.com/3684 ] 표준 상태와 표준 온도와 압력(STP)
[키워드] 탄화수소 연소 반응식 기준, 탄화수소 연소 기준, 탄화수소 연소 반응식 사전, 탄화수소 연소 반응 사전, 탄화수소 연소 사전
24. 탄화수소 (CmHn) 1 mol이 완전 연소될 때 발생하는 이산화탄소의 몰(mol) 수는 얼마인가?
'일반화학 > [03장] 화학량론' 카테고리의 다른 글
| 1 amu는 몇 g인가? 1 g은 몇 amu인가? ★ (1) | 2017.10.12 |
|---|---|
| 한계반응물. 27 °C, 1.02 atm에서 4.21 L의 부피를 갖는 NH3 (0) | 2017.10.10 |
| 아보가드로와 아보가드로수 (0) | 2017.09.21 |
| 알코올 연소 반응. alcohol combustion (0) | 2017.07.02 |
| 철의 제련. 160 g 산화철을 충분한 양의 일산화탄소와 반응 (0) | 2017.06.13 |
| 1.248 g 1.035 M HCl 30.00 mL 1.010 M NaOH 11.56 mL CaCO3 mass percent (1) | 2017.06.04 |
| balanced chemical equation. 균형 맞춘 화학 반응식 (0) | 2017.05.20 |
| 몰질량의 개념. 몰질량의 정의, 몰질량 설명 ★ (0) | 2017.05.14 |

댓글