연소분석. 실험식과 분자식
---------------------------------------------------
1. 원소 분석 실험 결과로부터 실험식 구하기
C = 40.9%, H = 4.58%, O = 54.5%
① 시료의 질량을 100.0 g이라 가정 -> %를 질량으로 바로 사용할 수 있다.
C = 40.9% → 40.9 g
H = 4.58% → 4.58 g
O = 54.5% → 54.5 g
② 질량으로부터 각 원자의 몰수 계산: g -> 몰수
몰질량의 정의로부터,
탄소 1몰의 질량 = 1 mol C = 12.01 g C
수소 1몰의 질량 = 1 mol H = 1.008 g H
산소 1몰의 질량 = 1 mol O = 16.0 g O
③ 몰 = 개수, 그런데 화학식에선 정수 사용 -> 가장 작은 정수 비 계산
실험 오차로 인해, 계산한 몰 비는 수소의 경우(3.99≒4)처럼 정확한(딱 떨어지는) 정수가 아닐 수도 있다.
실험식량 = 3(12.01) + 4(1.01) + 3(16.00) = 88.07
2. 분자식 구하기
[실험식과 질량 분석 실험 결과로부터 분자식 구하기]
시료의 분자량 = 176 g (Mass of molecular ion: 176)
실험식량 = 88.1 g (실험식으로부터 계산한 값)
분자량 = 6(12.01) + 8(1.01) + 6(16.00) = 176.14
( 176과 176.14가 차이나는 이유 https://ywpop.tistory.com/3390 )
[ 관련 글 https://ywpop.tistory.com/6947 ] 화학식량과 실험식량
[키워드] 실험식과 분자식 기준문서, 분자식과 실험식 기준문서
'화학' 카테고리의 다른 글
| 기체의 법칙 ★ (0) | 2012.06.20 |
|---|---|
| 기체의 압력 (0) | 2012.06.20 |
| 용액의 농도. 몰농도와 묽힘 (0) | 2012.06.20 |
| 산-염기 중화 반응 (0) | 2012.06.19 |
| 아보가드로(Avogadro) 수와 몰(mol) (0) | 2012.06.14 |
| 화학 반응의 종류 (0) | 2012.06.14 |
| 무기 화합물 명명법 (0) | 2012.06.11 |
| 분자와 분자 화합물 (0) | 2012.06.11 |





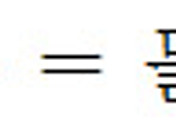
댓글