왜 (NH4)2SO4는 이온결합 화합물, H2SO4는 공유결합 분자?
NH4^+는 ‘다원자이온’이다.
( 참고: 다원자이온 https://ywpop.tistory.com/2968 )
즉, 이름에서 알 수 있듯이, NH4^+는 ‘이온’이다.
(+)전하를 가지므로, NH4^+는 ‘양이온’이다.
---------------------------------------------------
금속 양이온과 비금속 음이온 사이의
정전기적 인력에 의한 결합이 이온 결합이다.
이온 결합 = 금속 양이온 + 비금속 음이온
( 참고: 이온 결합 https://ywpop.tistory.com/8857 )
NH4^+는 전부 비금속이지만,
예외적으로 금속 양이온과 같은 역할을 한다.
( 그 이유는 필자도 모른다.
“NH4^+와 비금속 음이온으로 이루어진 화합물은 결정 구조를 갖는다.”
는 실험적 관찰 결과로부터 그렇게 설명하는 것일 수도 있다. )
( 참고로, NH4^+는 다원자이온 중 유일한 양이온이다.
즉, NH4^+를 제외한 모든 다원자이온은 음이온이다. )
“NH4^+는 금속 양이온과 같은 역할을 한다.”
는 것만 받아들이면 모든 문제는 해결된다.
(NH4)2SO4, NH4NO3는
[금속 양이온 + 비금속 음이온] 결합이므로, 이온 결합이다.
H2SO4, HNO3는
[비금속 양이온 + 비금속 음이온] 결합이므로, 이온 결합이 아니다.
또는 H와 O 사이의 공유 결합,
또는 H^+와 O^- 사이의 배위 공유 결합이다.
( 참고: 황산의 이온화 https://ywpop.tistory.com/15622 )
---------------------------------------------------
이온결합 화합물 = 금속 양이온 + 비금속 음이온
( 금속 양이온의 예외: NH4^+ )
( 즉, NH4^+만 유일하게, 비록 전부 비금속이지만,
금속 양이온처럼, 양이온으로 취급한다. Why? 그냥 외우세요. )
( 즉, NH4^+와 비금속 음이온으로 이루어진 물질은
이온결합 화합물이다. )
( 이온결합 화합물의 물리적 특징: 상온/상압 하에서,
고체 상태로 존재한다. )
따라서 (NH4)2SO4는 이온결합 화합물이고, ; (NH4)2SO4는 고체이다.
H2SO4는 공유결합 분자이다. ; H2SO4는 액체이다.
( 또한 H는 비금속이다. )
( 같은 이유로, HCl 역시 공유결합 분자이다. ; HCl은 기체이다. )
( 단, H2SO4, HNO3는 논란이 있다.
어떤 학자는 이온결합이라고 하고, 다른 학자는 공유결합이라고 한다. )
( 관련 자료 https://www.quora.com/What-type-of-bond-does-H2SO4-have-covalent-or-ionic )
[참고] SO4^2-, PO4^3- 도 ‘다원자이온’이다.
그래서 Na2SO4, Na3PO4는 이온결합 화합물이다.
단, H2SO4, H3PO4와 같이,
비금속인 H^+와 음이온으로 이루어진 화합물은
‘예외적으로’ 이온결합 화합물이 아니다. 라고 기억해도 좋다.
[핵심요약]
▶ 모든 화합물은 이온 결합 성질과 공유 결합 성질을 둘 다 갖고 있다.
▶ 이온 결합 화합물의 가장 큰 특징
---> 격자 구조를 갖기 때문에, 상온/상압 하에서 고체 상태로 존재한다.
즉, 이온 결합 화합물은 전부 고체다.
▶ H2SO4, HNO3는 액체다.
---> 공유 결합 화합물이다.
( 즉, 공유 결합 화합물에 조금 더 가깝다. )
( 이렇게 물질의 물리적 상태로 구분하고, 외우자. )
[참고] 그럼 NH4OH, 수산화암모늄도 이온결합 화합물인가?
라는 질문은 하지마세요. 왜냐하면,
NH4OH는 자연계에서 홀로, 단독으로, 분리되어 존재하지 않는 물질이다.
( 설명 https://ywpop.tistory.com/3954 )
NH3(g) + H2O(l) ⇌ NH4OH(aq)
위 용액을 가열하면,
즉 암모니아수가 들어있는 비커를 가열하면,
암모니아 기체와 물 기체(수증기)가 발생한다.
최종적으로 비커에는 아무것도 남아있지 않는다.
---> NH4OH란 물질은 존재하지 않는다.
HCl(aq) + NH4OH(aq) → NH4Cl(aq) + H2O(l)
위 용액을 가열하면,
즉 염산과 암모니아수의 중화반응이 일어난 비커를 가열하면,
최종적으로 백색 NH4Cl(s) 고체 결정이 얻어진다.
---> NH4Cl은 이온결합 화합물이다.
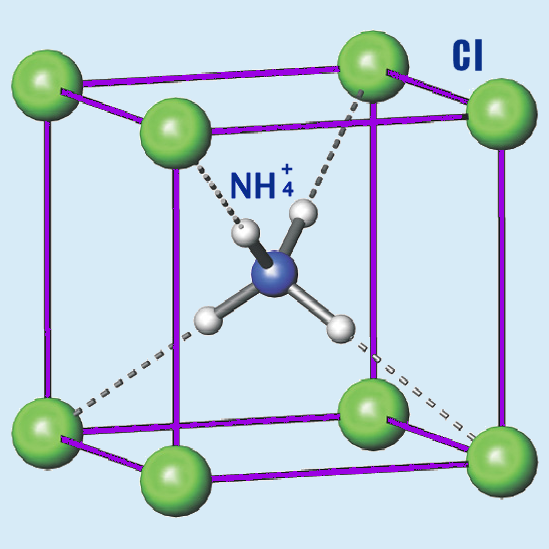
[그림] NH4Cl의 결정구조.
[키워드] H2SO4 ionic or covalent 기준, ionic or 기준, 황산은 공유 결합 기준, H2SO4는 공유 결합 기준, H2SO4 ionic or covalent dic, ionic or dic, 황산은 공유 결합 사전, H2SO4는 공유 결합 사전
'화학' 카테고리의 다른 글
| C3H6, C6H12, 각 1 g씩을 완전연소시키기 위해 필요한 산소의 질량 (0) | 2016.09.28 |
|---|---|
| g당량수와 당량수. 몰농도와 노르말농도 (0) | 2016.09.28 |
| 36.3% 염산 용액(d 1.18)에서 HCl 25 g 취하기 (0) | 2016.09.28 |
| 조성 백분율. 요소의 실험식 (0) | 2016.09.28 |
| 26℃, 1 atm에서 CO2 22 kg의 부피 (0) | 2016.09.27 |
| 극성 분자인 에틸 아세테이트(ethyl acetate)가 극성 분자인 물에 용해되지 않는 이유 (1) | 2016.09.27 |
| 삼투압. 글루코스의 분자량 측정 (0) | 2016.09.27 |
| 순도 20% (wt) NaOH 시약으로 1 M NaOH 용액 100 mL 만들기 (0) | 2016.09.27 |

댓글