1 M K2HPO4 용액 100 mL 만들기
K2HPO4 = dipotassium phosphate
------------------------
K2HPO4 = dipotassium phosphate
= potassium hydrogen phosphate
( 참고 https://en.wikipedia.org/wiki/Dipotassium_phosphate )
K2HPO4의 몰질량 = 174.18 g/mol 이므로,
1 M K2HPO4 용액 100 mL(= 0.1 L) 제조에 필요한
K2HPO4의 질량을 계산하면,
용질의 질량(g)
= 용액의 몰농도(mol/L) × 용액의 부피(L) × 용질의 몰질량(g/mol)
( 참고 https://ywpop.tistory.com/24161 )
= (1) (0.1) (174.18)
= 17.418 g
[용액 제조 방법]
1) 제조하려는 용액의 부피에 해당하는 부피 플라스크에다가
위에서 계산한 질량만큼의 고체 용질을 넣는다.
2) 제조하려는 용액의 부피의 대략 1/2에 해당하는 증류수를 가해
고체 용질을 완전히 용해시킨다.
※ 고체의 용해 과정이 발열(흡열) 반응이면,
용액의 온도가 변하므로, 이때는
용액의 온도를 실온과 같게 만든다.
3) 부피 플라스크의 표선(calibration mark)까지 증류수를 마저 채운다. 끝.
( 참고 https://ywpop.tistory.com/7615 )
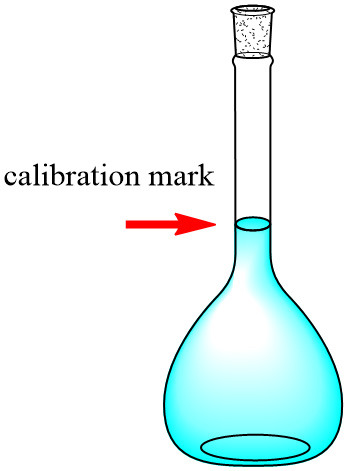
[ 관련 글 https://ywpop.tistory.com/471790 ]
1 M KH2PO4 용액 100 mL 만들기
[키워드] K2HPO4 기준, K2HPO4 몰농도 기준, K2HPO4 사전, K2HPO4 몰농도 사전, K2HPO4 용액의 몰농도 기준, K2HPO4 용액의 몰농도 사전
'화학 > 용액의 농도' 카테고리의 다른 글
| 2.05 M CaCl2 용액(d 1.17)의 질량 백분율 농도 (10) | 2025.10.14 |
|---|---|
| 1 ppm(부피기준)을 %와 mL/m3 농도 단위로 환산 (6) | 2025.10.10 |
| 10% NaOH(aq) 10 g 4 g 0.1 M NaOH(aq) x mL (1) | 2025.10.10 |
| 1 M KH2PO4 용액 100 mL 만들기 (0) | 2025.10.10 |
| 49% HF 용액 1 L를 10% 농도로 희석하기 (8) | 2025.09.29 |
| 염분이 35 psu인 해수 2 kg에 염화나트륨이 27 g 녹아있다 (11) | 2025.09.24 |
| 40.0 mmol/L 염산 20.0 mmol/L 수산화나트륨 등량 혼합 pH (2) | 2025.09.19 |
| 10% NaOH(aq) 용액 4 g + 증류수로 만든 0.1 M NaOH(aq)의 부피(mL) (3) | 2025.08.28 |

댓글