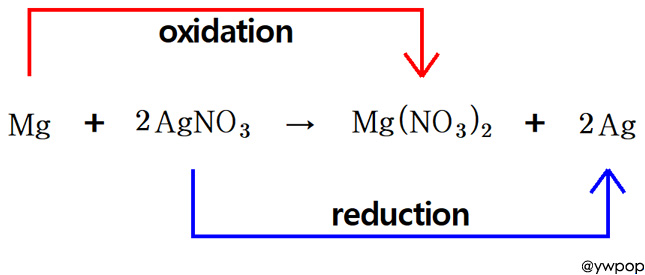
redox 2AgNO3 + Mg → Mg(NO3)2 + 2Ag
[참고] redox 2AgNO3 + Mg → Mg(NO3)2 + 2Ag
[ https://ywpop.tistory.com/16751 ]
▶ 분자 반응식
Mg(s) + 2AgNO3(aq) → Mg(NO3)2(aq) + 2Ag(s)
▶ 알짜 이온 반응식
Mg(s) + 2Ag^+(aq) → Mg^2+(aq) + 2Ag(s)
[주의]
Mg(s) + 2AgNO3(aq) → Mg^2+(aq) + 2NO3^-(aq) + 2Ag(s)
반응식을 이렇게 쓰면 절대로 안 된다.
AgNO3(aq), Mg(NO3)2(aq),
둘 다 가용성염이므로,
즉, 둘 다 수용액 상태이므로,
2AgNO3(aq) → Mg(NO3)2(aq)
이렇게 표기하거나, 아니면,
2Ag^+(aq) + 2NO3^-(aq) → Mg^2+(aq) + 2NO3^-(aq)
이렇게 표기해야 한다.
즉, 둘 다 분자 상태로 나타내든,
둘 다 이온 상태로 나타내든,
동일하게 표시해 주어야 한다.
1. 금속의 반응성: Mg > Ag
( 참고 https://ywpop.tistory.com/3195 )
2. 산화 반응식
> Mg + 2NO3^- → Mg(NO3)2 또는
> Mg → Mg^2+ + 2e^-
3. 환원 반응식
> 2AgNO3 → 2Ag + 2NO3^- 또는
> 2Ag^+ + 2e^- → 2Ag
4. 화학 반응을 전체 반응식으로 나타내시오.
산화수 변화가 있는 원자는 산화수 변화를 나타내시오.
전체 반응식을 나타내는 방법
① 분자 반응식
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
② 완전 이온 반응식
Mg + 2Ag^+ + 2NO3^- → Mg^2+ + 2NO3^- + 2Ag
분자 반응식으로 나타내면,
Mg ---> Mg(NO3)2
이렇게 연결하고, “산화수 2 증가”.
> Mg의 산화수 = 0
> Mg(NO3)2에서 Mg의 산화수 = +2
2AgNO3 ---> 2Ag
이렇게 연결하고, “산화수 1 감소”.
> AgNO3에서 Ag의 산화수 = +1
> Ag의 산화수 = 0
※ NO3에서 산화수가 변한 원자는 없으므로,
NO3의 산화수는 나타낼 필요가 없다.
※ 연결하는 화살표의 시작과 끝 위치를
산화수가 변한 원자의 중심에 맞추어도 된다.
[키워드] redox Mg + AgNO3, redox AgNO3 + Mg, redox Mg + Ag^+, redox Ag^+ + Mg
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 0.05 M 황산 10 mL 중화에 필요한 1/25 N 수산화소듐의 양 (1) | 2025.02.19 |
|---|---|
| 알짜이온반응식 Ba(NO3)2 + Na2SO4. BaSO4 침전 (2) | 2025.02.01 |
| 알짜이온반응식 Fe(NO3)2 + (NH4)2CO3. FeCO3 침전 (2) | 2025.02.01 |
| redox Cu^+ + O2 → Cu^2+ + O2^2- (1) | 2024.12.25 |
| 증류수에 NaOH 400 mg을 가하여 1 L로 제조한 용액의 pH (1) | 2024.12.18 |
| 0.25 M HCl 수용액 200 mL 2000 mg NaOH(s) 온도 5℃ 상승 (3) | 2024.12.12 |
| 알짜 Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O(l) (1) | 2024.12.07 |
| 알짜 3Cu(s) + 8HNO3(aq) → 3Cu(NO3)2(aq) + 2NO(g) + 4H2O(l) (0) | 2024.12.07 |
댓글