염분의 정의 및 계산
염분비 일정 법칙
[참고] 염화나트륨, NaCl은 염(salt)이며,
이 NaCl이 바닷물 속에 있으면,
염류(salts, saline)라고도 한다.
해수(바닷물) 속에 용해되어 있는 물질(무기물)을 ‘염류’라고 하며,
해수 1 kg 속에 용해되어 있는 염류의 질량비를 ‘염분’이라 한다.

염분(‰) = (염류의 g수 / 해수의 g수) × 1000
> 염분의 단위: ‰(퍼밀) = ppt
(염류의 g수 / 해수의 g수) × 100 하면,
즉 100을 곱하면, 백분율(%)이고,
( 참고: 질량 백분율 https://ywpop.tistory.com/2656 )
(염류의 g수 / 해수의 g수) × 1000 하면,
즉 1000을 곱하면, 천분율(‰).
예 1) 해수 1 kg 중에 염류가 25 g 용해되어 있다면,
염분 = (25 g / 1000 g) × 1000 = 25‰
예 2) 해수 0.5 kg 중에 염류가 10 g 용해되어 있다면,
염분 = (10 g / 500 g) × 1000 = 20‰
예 3) 해수 2.5 kg 중에 염류가 60 g 용해되어 있다면,
염분 = (60 g / 2500 g) × 1000 = 24‰
[ 관련 글 https://ywpop.tistory.com/9122 ] 염분농도 ppt 값과 psu 값은 같다
[ 관련 글 https://ywpop.tistory.com/6965 ] 천분율. ppt, parts per thousand
[키워드] 천분율 기준, ppt 기준, 퍼밀 기준, 천분율 사전, ppt dic, 퍼밀 사전
---------------------------------------------------
▶ 염분비 일정 법칙
( law of the regular salinity ratio )
> 염분은 바다에 따라 다르게 나타나지만
전체 염분 중에서 각각의 염류가 차지하는 구성비는
모든 바다에서 일정하다.
해수 속에 용해되어 있는 주요 염류와 구성 비율은 다음과 같으며,
‘염분비 일정의 법칙’에 따라 염류의 구성 비율은
지구상의 어느 바다에서나 동일하다.
1. 염화나트륨(NaCl): 77.74%
2. 염화마그네슘(MgCl2): 10.89%
3. 황산마그네슘(MgSO4): 4.74%
4. 황산칼슘(CaSO4): 3.60%
5. 황산칼륨(K2SO4): 2.46%
6. 탄산칼슘(CaCO3): 0.34%
7. 브로민화마그네슘(MgBr2): 0.23%
> 염분 = 염분도 = 염도 = salinity
> 염류의 주성분: 염화나트륨, 염화마그네슘, 황산마그네슘, 황산칼슘, 황산칼륨
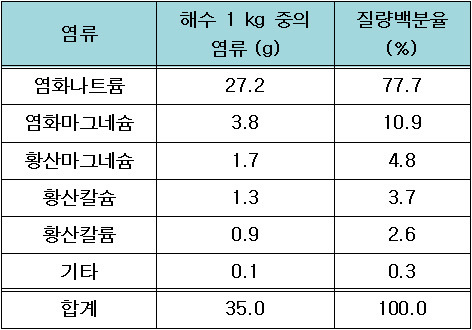
※ 염분이 35.0 psu인 해수 1 kg 속에 들어있는 염화나트륨의 양 = 27.2 g
[ 관련 예제 https://ywpop.tistory.com/12563 ] 염분이 42 psu인 해수 1 kg 속에 들어있는 염화나트륨의 양
[키워드] 염분 기준, 염도 기준, 염류 기준, 염분의 정의 기준, 염도의 정의 기준, 염류의 정의 기준, 염분 사전, 염도 사전, 염류 사전, 염분의 정의 사전, 염도의 정의 사전, 염류의 정의 사전
[Google 검색 실적] 2021년 12월 인기 상승 페이지
[Google 검색 실적] 2020년 12월 인기 상승 페이지
'화학 > 용액의 농도' 카테고리의 다른 글
| 10% w/v 설탕물 용액의 몰농도 (0) | 2016.03.12 |
|---|---|
| 1000 mg Hg/L 표준용액 100 mL를 염화수은(HgCl2)으로 조제 (0) | 2015.12.31 |
| 0.025 N Na2S2O3 용액 1 L 제조 방법 (0) | 2015.12.22 |
| 50% HCl(비중 1.20)은 몇 w/v% (0) | 2015.12.14 |
| 희석배율, 몇배희석, 희석률, 희석율 ★ (4) | 2015.12.11 |
| 5% 과산화수소수(H2O2)의 몰농도(M) (0) | 2015.12.11 |
| 10% HCl 용액의 노르말농도(N) (0) | 2015.12.11 |
| 약산의 짝염기염의 노르말농도. normality of Na2CO3 (0) | 2015.12.09 |

댓글