퍼센트(%) 농도를 몰농도(M)로 변환하는 공식 설명
- 공식에서 10을 곱하는 이유
[% → M 변환공식]
몰농도 = (wt% / 몰질량) × 밀도 × 10
▶ 몰농도 = (wt% / 몰질량) × 밀도 × 10
▶ wt% = 몰농도 × 몰질량 / (밀도 × 10)
[ 관련 예제 https://ywpop.tistory.com/8915 ]
예를 들어, 35%를 몰농도로 변환할 경우,
wt%에 대입하는 값은 숫자 35를 그대로 대입합니다.
그러나 35%를 숫자로 나타내면, 0.35입니다.
( 35%란 전체 100개 중 35개이므로, 35/100 = 0.35입니다. )
즉, 원래는 35 대신 0.35를 대입해야 하는데,
( 만약 여기서 0.35를 대입하면, 뒤에서 10 대신 1000을 곱해야 됩니다. )
그냥 편리하도록 퍼센트 농도 값을 그대로 대입하게 만들었습니다.
그러나 실제 공식에 사용된 숫자(식)는 (0.35 × 100) 입니다.
변환공식에 사용된 값들의 단위를 정리하면, mol/mL가 남습니다.
(g/g) / (g/mol) × g/mL = mol/mL
그런데 M농도 단위는 mol/L이죠.
그래서 mol/L가 되게끔 mL를 L로 환산하려면 1000을 곱해야 하는데,
mol/mL × (1000 mL / 1 L) = mol/L
앞에서 100을 곱했기 때문에(0.35 × 100) 10만 곱한 겁니다.
즉, 공식에서 10 (또는 1000) 은 mL를 L로 환산하기 위해 곱한 것입니다.
[ 관련 글 https://ywpop.tistory.com/4242 ] 28% NH3 시약(d 0.898, FW 17)의 몰농도
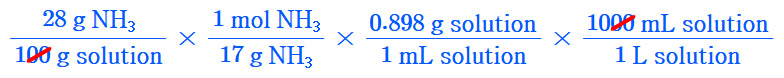
변환공식은 위 환산인자를 이용한 계산식에서 나온 것입니다.
즉, 위 계산식을 토대로 누군가가 공식으로 만든 것이죠.
[ 관련 글 https://ywpop.tistory.com/18635 ] 37% 염산 시약(d 1.18, FW 36.5)의 몰농도

---------------------------------------------------
40% 용액으로 0.02 M 용액 500 mL를 제조하는 방법
(단, 용질의 몰질량 = 259.48 g/mol)
[1] 40% 용액의 밀도를 모르는 경우
0.02 M 용액 500 mL 제조에 필요한 40% 용액의 질량은
다음 공식으로 계산할 수 있다.
용액의 질량(g) = 몰농도(mol/L) × 부피(L) × 몰질량(g/mol) × (100/%농도)
= 0.02 × 0.5 × 259.48 × (100/40) = 6.5 g
따라서 40% 용액 6.5 g에다
500 mL 되도록 증류수를 가하면,
0.02 M 용액 500 mL가 된다.
[2] 40% 용액의 밀도를 아는 경우
만약 용액의 밀도가 0.9 g/mL이면,
6.5 g / (0.9 g/mL) = 7.2 mL
따라서 40% 용액 7.2 mL에다
500 mL 되도록 증류수를 가하면,
0.02 M 용액 500 mL가 된다.
따라서 만약 용액의 밀도까지 알고 있다면,
용액의 부피(mL) = 몰농도(mol/L) × 부피(L) × 몰질량(g/mol) × (100/%농도) / 밀도(g/mL)
= 0.02 × 0.5 × 259.48 × (100/40) / 0.9 = 7.2 mL
[a M → %농도]
%농도 = 몰농도 × 화학식량 / 10d
= a × 화학식량 / 10d
( d: 용액의 밀도 )
[a% → 몰농도]
몰농도 = (%농도 / 화학식량) × 10d
= 10ad / 화학식량
[ 관련 글 https://ywpop.tistory.com/17003 ] 몰농도를 %농도로 환산
[키워드] 10 곱하는 이유 기준문서, 10 곱해주는 이유 기준문서, 퍼센트 농도를 몰농도로 기준문서, %농도를 몰농도로 기준문서, 변환 공식 기준문서, 환산 공식 기준문서, 10 곱하는 이유 사전, 10 곱해주는 이유 사전, 퍼센트 농도를 몰농도로 사전, %농도를 몰농도로 사전, 변환 공식 사전, 환산 공식 사전, 질량백분율을 몰농도로 기준, 질량백분율을 몰농도로 사전
'화학 > 용액의 농도' 카테고리의 다른 글
| 용질이 여러 개인 용액의 몰농도 계산은 어떻게? (1) | 2015.11.30 |
|---|---|
| %농도를 몰농도로 환산할 때 100 g (0) | 2015.11.24 |
| 몰농도 용액 제조 방법. 용질이 고체인 경우 (0) | 2015.11.19 |
| What is the molarity of the concentrated ammonia (NH3)? (3) | 2015.11.12 |
| 황산의 밀도 도표 (0) | 2015.10.28 |
| KIO3의 당량수. 아이오딘산칼륨의 당량수 (2) | 2015.10.28 |
| 티오황산나트륨(sodium thiosulfate, Na2S2O3)의 당량수(equivalent) (4) | 2015.10.27 |
| KMnO4 용액의 노르말농도. 50 ppm KMnO4 용액 200 mL (0) | 2015.10.23 |




댓글