[Mn(CN)6]^5-, [Mn(CN)6]^4-, [Mn(CN)6]^3- 전자배치
The complex ions [Mn(CN)6]^5-, [Mn(CN)6]^4-, and [Mn(CN)6]^3-
have all been synthesized and all are low-spin octahedral complexes.
For each complex, determine the oxidation number of Mn,
the configuration of the d-electrons (how many t_2g and how many e_g),
and how many unpaired electrons are present.
For the low-spin complex ion [Mn(CN)6]^5-,
determine the oxidation number for Mn,
and the number of unpaired d electrons.
---------------------------------------------------
▶ 참고: 전이금속
[ https://ywpop.tistory.com/7346 ]
---------------------------------------------------
▶ Mn의 바닥상태 전자배치
> 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^5
> 축약형: [Ar] 3d^5 4s^2
( 참고: 축약형 https://ywpop.tistory.com/7269 )
▶ [Mn(CN)6]^5-, [Mn(CN)6]^4-, [Mn(CN)6]^3-
---> 모두 low-spin octahedral complexes
( 참고: 저스핀 고스핀 https://ywpop.tistory.com/11952 )
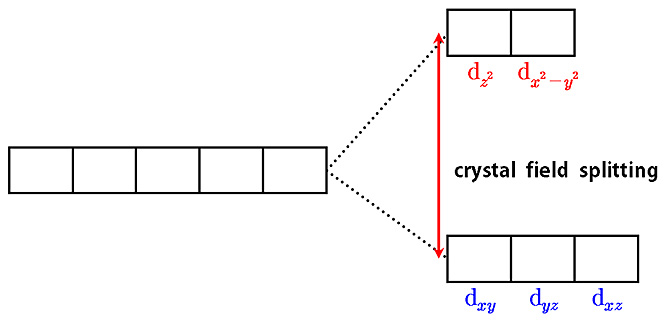
[그림] d 오비탈의 분리.
▶ Mn^+ 이온의 바닥상태 전자배치
> [Ar] 3d^5 4s^1
▶ [Mn(CN)6]^5- 착 이온에서, Mn의 전자배치
> 3d^5 4s^1 ---> d^6
> Mn의 산화수 = +1
> t_2g: 6개 전자
> e_g: 전자 없음
> unpaired d electrons: 0개
( 참고: d^6 전자배치 https://ywpop.tistory.com/2909 )

[그림] [Mn(CN)6]^5- 착 이온의 d^2sp^3 혼성 오비탈.
▶ Mn^2+ 이온의 바닥상태 전자배치
> [Ar] 3d^5
▶ [Mn(CN)6]^4- 착 이온에서, Mn의 전자배치
> Mn의 산화수 = +2
> t_2g: 5개 전자
> e_g: 전자 없음
> unpaired d electrons: 1개
( 참고: d^5 전자배치 https://ywpop.tistory.com/2908 )

[그림] [Mn(CN)6]^4- 착 이온의 d^2sp^3 혼성 오비탈.
▶ Mn^3+ 이온의 바닥상태 전자배치
> [Ar] 3d^4
▶ [Mn(CN)6]^3- 착 이온에서, Mn의 전자배치
> d^4 전자배치
> Mn의 산화수 = +3
> t_2g: 4개 전자
> e_g: 전자 없음
> unpaired d electrons: 2개
( 참고: d^4 전자배치 https://ywpop.tistory.com/2907 )
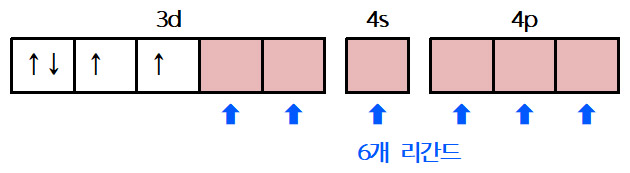
[그림] [Mn(CN)6]^3- 착 이온의 d^2sp^3 혼성 오비탈.
[키워드] Mn 착 이온 기준문서, 망간 착 이온 기준문서, d2sp3 혼성 오비탈 기준문서, d^2sp^3 혼성 오비탈 기준문서
'일반화학 > [23장] 전이 금속과 배위 화학' 카테고리의 다른 글
| 지르코늄의 산화수. Zr의 산화수 (1) | 2024.03.29 |
|---|---|
| [명명법] [Co(NH3)4CO3]NO3 [Co(NH3)5Cl]Cl2 (4) | 2023.04.18 |
| pH 10에서 EDTA의 구조 (1) | 2023.03.30 |
| [Co(NH3)4Cl2]^+ 기하 이성질체 개수와 Co의 산화수 (3) | 2023.02.08 |
| [Mn(CN)6]^4- + e^- ⇌ [Mn(CN)6]^5- reaction (0) | 2022.12.13 |
| [Co(en)2(H2O)Br]^2+ 착이온의 배위수, 산화수 (0) | 2022.12.01 |
| 구리가 +2가 양이온인 이유 (1) | 2022.08.23 |
| [Fe(H2O)6]^2+ 착이온의 전자배치와 자기적 성질 (0) | 2022.08.22 |


댓글