728x170
NOF의 산화수
---------------------------------------------------
▶ 참고: 산화수 구하는 규칙
[ https://ywpop.tistory.com/2719 ]
---------------------------------------------------
NOF 에서,
F의 산화수 = –1 (넘버 1) 이고,
O의 산화수 = –2 (넘버 3) 이므로,
(N) + (O) + (F) = 0
(N) + (–2) + (–1) = 0
따라서
N의 산화수 = +3.
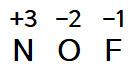
[ 관련 글 https://ywpop.tistory.com/9944 ] NO의 산화수
[키워드] NOF의 산화수 기준문서
반응형
그리드형(광고전용)
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| redox Co + S → CoS (0) | 2022.11.28 |
|---|---|
| redox 2Na + H2 → 2NaH (0) | 2022.11.28 |
| AgNO3 10.0 g 1.0×10^(-2) M NaCl 50. mL AgCl (0) | 2022.11.20 |
| redox 2NO + F2 → 2NOF (0) | 2022.11.19 |
| P4O10의 산화수 (0) | 2022.11.13 |
| 산화-환원 반응. PCl3 + Cl2 → PCl5 (1) | 2022.11.13 |
| redox C2H4O + H2 → C2H6O (0) | 2022.11.07 |
| 탄산의 이온화. H2CO3의 이온화 (0) | 2022.11.03 |

댓글