295 K 0.265 atm Kc NH4HS(s) ⇌ NH3(g) + H2S(g)
295 K에서 다음 평형을 생각해 보자.
NH4HS(s) ⇌ NH3(g) + H2S(g)
각 기체들의 부분 압력은 모두 0.265 atm이다.
이 반응의 Kp와 Kc를 계산하시오.
Consider the following equilibrium at 295 K:
NH4HS(s) ⇌ NH3(g) + H2S(g)
The partial pressure of each gas is 0.265 atm.
Calculate Kp and Kc for the reaction.
---------------------------------------------------
ICE 도표를 작성하면,
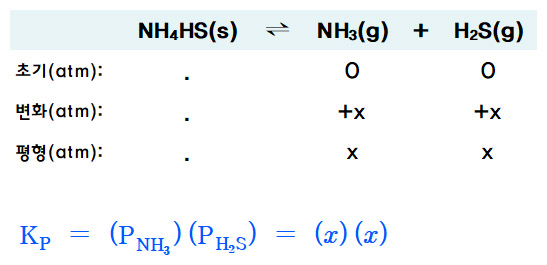
Kp = P_NH3 × P_H2S
= (0.265 atm) (0.265 atm)
= 0.0702
Kp = Kc(RT)^Δn
( 참고 https://ywpop.tistory.com/6523 )
Δn = 기체 생성물의 몰수의 합 – 기체 반응물의 몰수의 합
= (1 + 1) – (0) = 2
Kc = Kp / (RT)^Δn
= 0.0702 / (0.08206 × 295)^2
= 0.00012
= 1.2×10^(-4)
답: Kp = 0.0702, Kc = 1.2×10^(-4)
[ 관련 예제 https://ywpop.tistory.com/8259 ] 395 K 0.265 atm Kc NH4HS(s) ⇌ NH3(g) + H2S(g)
[키워드] 295 K 0.265 atm Kc NH4HS(s) ⇌ NH3(g) + H2S(g)
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| 르 샤틀리에. F2 + Cl2 ⇌ 2ClF + 열 반응에서 Cl2 양 (0) | 2022.11.02 |
|---|---|
| 2NOBr(g) ⇌ 2NO(g) + Br2(g) density 4.495 g/L 4.086 g/L (1) | 2022.10.22 |
| 르 샤틀리에 원리. CO(g) + 2H2(g) ⇌ CH3OH(g) (1) | 2022.10.22 |
| 800. K 50. L 3.00 mol CO 2.00 mol Cl2 9.00 mol COCl2 Kc (1) | 2022.10.14 |
| 르 샤틀리에 2CO(g) + O2(g) ⇌ 2CO2(g) (1) | 2022.09.30 |
| 균일 평형. H2O(l) ⇌ H^+(aq) + OH^-(aq) (0) | 2022.09.27 |
| 반응 속도식에서 탄생한 평형상수 (1) | 2022.09.19 |
| 이론적 평형상수. CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) (0) | 2022.09.17 |

댓글