728x170
H2S와 HCl의 끓는점 비교
Why does H2S have a high boiling point than HCl?
---------------------------------------------------
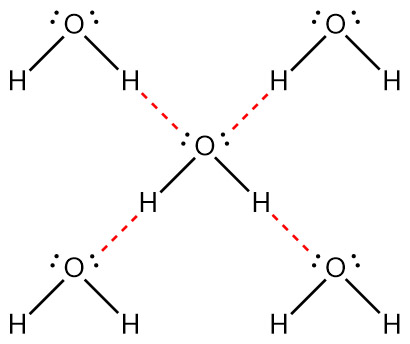
[그림] 물 분자의 수소 결합.
물 1개 분자당 4개의 수소 결합.
( 참고 https://ywpop.tistory.com/2597 )
H2S, HCl, 둘 다 극성 결합으로 이루어진 극성 분자인데,
H2S는 한 분자당 4개의 쌍극자-쌍극자 힘으로 상호작용하고 있고,
( H2S와 H2O의 분자 기하구조가 유사하기 때문에,
H2S와 H2O의 분자간 힘 작용 방식은 동일하다. )
HCl은 한 분자당 2개의 쌍극자-쌍극자 힘으로 상호작용하고 있다.
비록 몰질량은 HCl이 더 크지만,
H2S의 분자당 상호작용 개수가 더 많기 때문에,
H2S의 끓는점이 더 높다.
[참고]
> H2S의 끓는점: –60℃ (H2S의 몰질량 = 34.08 g/mol)
> HCl의 끓는점: –85.05℃ (HCl의 몰질량 = 36.46 g/mol)
[키워드] H2S HCl boiling point 기준문서, H2S HCl 끓는점 기준문서, HCl H2S 끓는점 기준문서
반응형
그리드형(광고전용)
'일반화학 > [11장] 액체와 분자간의 힘' 카테고리의 다른 글
| 물에 대한 용해도가 증가하는 순서대로 나열 (1) | 2022.09.07 |
|---|---|
| 물과 얼음의 밀도 크기 비교 (0) | 2022.06.26 |
| Al2O3 F2 H2O Br2 ICl NaCl. 끓는점 순서 (0) | 2022.06.15 |
| 분자량이 증가하면 녹는점 끓는점이 높아진다 (1) | 2022.06.10 |
| CH3Br에 존재하는 분자간 힘의 종류 (0) | 2022.05.26 |
| 분자간 힘의 크기 순서. He HF F2 Ne (0) | 2022.05.26 |
| 산소와 포스핀의 끓는점 (0) | 2022.05.17 |
| 물에 대한 용해도. (CH3CH2)3N vs. CH3CH2OCH2CH3 (0) | 2022.03.30 |

댓글