728x170
황산의 노르말농도. 10.0 g H2SO4에 물을 가해서 250 mL
10.0 g의 H2SO4에 물을 가해서 250 mL의 용액을 만들었다.
이 용액의 노르말농도는 얼마인가?
-----------------------------------------
H2SO4의 몰질량 = 98.08 g/mol 이므로,
10.0 g / (98.08 g/mol) = 0.102 mol H2SO4
( 계산 설명 http://ywpop.tistory.com/7738 )
H2SO4의 당량수 = 2 eq/mol 이므로, ( 설명 http://ywpop.tistory.com/4105 )
0.102 mol * (2 eq/mol) = 0.204 eq H2SO4
노르말농도 = 0.204 eq / 0.250 L
= 0.816 eq/L
= 0.816 N
답: 0.816 N
[ 관련 예제 http://ywpop.tistory.com/8639 ]
반응형
그리드형(광고전용)
'화학' 카테고리의 다른 글
| 난용성염은 비전해질인가 (0) | 2018.03.29 |
|---|---|
| 18 M 황산 시약으로 9 N 황산 용액 60 mL 만들기 (0) | 2018.03.28 |
| 0.25 M NaI 용액 30.0 mL + 0.10 M Pb(NO3)2 용액 45.0 mL (0) | 2018.03.28 |
| mg/m3 to ppm. 오존 농도는 10 mg O3/m3 Air로 규제 (0) | 2018.03.28 |
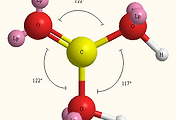
| 탄산의 결합각. bond angles of carbonic acid (0) | 2018.03.27 |
| 약산-강염기 적정. 적정 중 0.1 M CH3COOH + 0.1 N NaOH (0) | 2018.03.27 |
| 35% 염산(d 1.18, FW 36.46) 시약으로 6 M HCl 용액 250 mL 만들기 (0) | 2018.03.27 |
| 0.113 N HCl 용액 50 mL와 반응하는 0.223 N NaOH의 부피 (0) | 2018.03.27 |
댓글