선 스펙트럼. 방출 스펙트럼과 흡수 스펙트럼
▶ 스펙트럼은 ① 연속 스펙트럼과 ② 선 스펙트럼으로 구분한다.
> 방출 스펙트럼과 흡수 스펙트럼은 선 스펙트럼에 속한다.
원자의 선 스펙트럼은
원자가 에너지를 방출할 때도 나타나고, (방출 스펙트럼)
> 들뜬상태에서 바닥상태로 전이할 때 에너지 방출
> 이 에너지를 측정하여 그래프로 그린 것이 방출 스펙트럼
원자가 에너지를 흡수할 때도 나타난다. (흡수 스펙트럼)
> 바닥상태에서 들뜬상태로 전이할 때 에너지 흡수
> 이 에너지를 측정하여 그래프로 그린 것이 흡수 스펙트럼
한 원자의 오비탈의 에너지 준위는 같기 때문에,
즉, 바닥상태와 들뜬상태의 에너지 차이는 같기 때문에,
방출 스펙트럼과 흡수 스펙트럼에서 관찰되는 파장은 같다.
이것은 2층에서 7층으로 올라갈 때 올라간 층수와
7층에서 2층으로 내려올 때 내려온 층수는 같다는 것과 같은 원리다.

[ 그림 출처 commons.wikimedia.org ] E1과 E2의 에너지 차이는 같다.
E = hν = hc / λ
( 참고 https://ywpop.tistory.com/4964 )
---> h와 c는 상수이므로,
에너지(E)가 같으면, 파장(λ)도 같다.

[ 그림 출처 commons.wikimedia.org ] 방출선의 위치와 흡수선의 위치는 같다.
선 스펙트럼은 기체를 구성하는 원소들이
항상 특정한 파장의 에너지만을 흡수하거나 방출하기 때문에 나타난다.
따라서 한 종류의 원소에서 관찰되는 흡수선과 방출선의 위치는 같다.
[ 관련 글 https://ywpop.tistory.com/11127 ] 방출 스펙트럼과 흡수 스펙트럼
[ 관련 글 https://ywpop.tistory.com/8359 ] 백열등과 형광등의 발광 원리와 스펙트럼
[ 관련 글 https://ywpop.blogspot.com/2024/05/suns-spectrum-solar-spectrum.html ]
Sun’s spectrum. Solar spectrum
선 스펙트럼에서 선의 위치는
원자 내 전자가 들뜰 때 흡수하는 에너지의 파장을 나타내며,
원자마다 선의 위치(파장)와 개수가 고유하므로,
이것으로 원자의 종류를 알아낼 수 있다.
선의 굵기는 원자의 양(농도)에 비례한다.
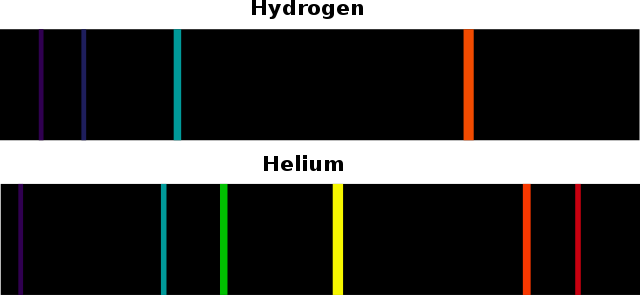
[ 출처 commons.wikimedia.org ] 수소와 헬륨의 원자 방출 스펙트럼(atomic emission spectrum).
두 개의 스펙트럼을 비교하면, 선의 위치와 개수가 서로 다르다는 것을 확인할 수 있다.

[ 출처 commons.wikimedia.org ] 원자 흡수 분광기. atomic absorption spectroscopy.
[키워드] 선 스펙트럼 기준문서, 방출 스펙트럼 기준문서, 흡수 스펙트럼 기준문서, 원자 분광법 기준문서, 선 스펙트럼 사전, 방출 스펙트럼 사전, 흡수 스펙트럼 사전, 원자 분광법 사전, 흡수선과 방출선의 파장 기준문서, 흡수선과 방출선 기준문서, 방출선과 흡수선의 파장 기준문서, 방출선과 흡수선 기준문서, 흡수선과 방출선의 파장 사전, 흡수선과 방출선 사전, 방출선과 흡수선의 파장 사전, 방출선과 흡수선 사전
'일반화학 > [06장] 원자의 전자 구조' 카테고리의 다른 글
| 물질파. 250 cm/s 중성자의 파장 (0) | 2018.05.08 |
|---|---|
| 보어가 완성한 수소 원자의 n번째 궤도의 에너지 계산식 (3) | 2018.05.07 |
| Cr의 원자가전자 수와 최외각전자 수 (0) | 2018.04.14 |
| 각 껍질당 최대 전자수. 2n^2 ★ (4) | 2018.04.14 |
| 백열등과 형광등의 발광 원리와 스펙트럼 (0) | 2017.12.25 |
| 양성자와 양전자의 질량 (0) | 2017.12.03 |
| 전자기파의 파장 영역. 가시광선, 자외선, 적외선 ★ (0) | 2017.11.18 |
| 원자를 만든 조물주의 브리핑 (2) | 2017.10.02 |


댓글