왜 탄소 간 결합은 단일 결합, 이중 결합, 삼중 결합, 3개밖에 없나요?
탄소는 원자가 전자가 4개여서 최대 4개의 원자와 공유 결합을 할 수 있는데,
왜 탄소 간 결합은 단일 결합, 이중 결합, 삼중 결합, 3개밖에 없나요?
탄소 간 사중 결합은 없나요?
[가장 간단한 답변]
탄소 원자는 결합에 이용할 수 있는 오비탈이
s 오비탈, p 오비탈 밖에 없기 때문입니다.
즉, 탄소 원자는 d 오비탈이 없기 때문입니다.
또한 이것은 탄소의 혼성 오비탈이
sp3, sp2, sp 혼성 오비탈, 이렇게 3개까지만 있다는 것과 관련 있습니다.
( 참고: 탄소의 혼성 오비탈 https://ywpop.tistory.com/2938 )
최대 결합수인 삼중결합을 하는 sp 혼성 오비탈에서,
2개 sp 혼성 오비탈이 z축 방향으로 놓여있다면,
비혼성 p 오비탈 2개는 각각 x축, y축 방향에 놓여있습니다.
sp 혼성 오비탈을 갖는 탄소 원자 2개가 서로 결합을 하기 위해 z축 방향으로 접근하면,
1개 sp 혼성 오비탈끼리 head-to-head overlap에 의해 1개 시그마 결합,
x축 방향에 놓인 비혼성 p 오비탈끼리 side-by-side overlap에 의해 1개 파이 결합,
y축 방향에 놓인 비혼성 p 오비탈끼리 side-by-side overlap에 의해 또 1개 파이 결합,
이렇게 3개 결합, 즉 삼중결합을 하게 됩니다.

삼중결합을 하는 탄소는
2개의 sp 혼성 오비탈([1], [2]),
1개의 px 비혼성 오비탈([3]),
1개의 py 비혼성 오비탈([4]),
이렇게 총 4개의 오비탈을 갖고 있다.

구글에서 carbon sp hybrid orbitals 로 검색하면
관련 그림을 많이 볼 수 있습니다.
전자쌍 반발 이론에 따른 오비탈의 기하 구조상
탄소의 4개 오비탈들이
접근하는 축 방향으로 모두 배향할 수 없으므로,
탄소의 사중결합은 불가능합니다.
( 참고: VSEPR https://ywpop.tistory.com/2571 )

---------------------------------------------------
1) 탄소 원자는 2s 오비탈 1개, 2p 오비탈 3개,
이렇게 총 4개 오비탈이 결합에 참여할 수 있습니다.
2) 탄소 원자가 다른 원자와 결합을 할 때는 이 4개의 오비탈을 적절히 혼합해서,
a) 4개의 sp3 혼성오비탈을 만들거나,
b) 1개의 p 오비탈을 남겨두고, 3개의 sp2 혼성오비탈을 만들거나,
c) 2개의 p 오비탈을 남겨두고, 2개의 sp 혼성오비탈을 만드는 방법 밖에 없습니다.
( 참고: 탄소의 혼성 오비탈 https://ywpop.tistory.com/2938 )
c)의 경우, 2개의 p 오비탈이 상대편 원자의 p 오비탈과 각각 겹쳐져서 2개의 파이결합을 형성하고, 1개의 sp 혼성오비탈이 상대편 원자의 sp 혼성오비탈과 겹쳐져서 1개의 시그마결합을 형성해서, 최종적으로 삼중결합을 이룹니다.
이때 남아있는 1개의 sp 혼성오비탈은 다른 sp 혼성오비탈과 반대쪽 직선상에 놓여있기 때문에, 삼중결합하고 있는 상대편 원자의 남아있는 sp 혼성오비탈과 겹쳐질 수 없습니다.
남아있는 1개의 sp 혼성오비탈은 또 다른 제 3의 원자와 결합할 수밖에 없습니다.
이런 이유로 탄소 원자는 사중결합이 불가능합니다.
참고로,
a)는 단일결합 4개 = 총 결합수 4개
b)는 이중결합 1개, 단일결합 2개 = 총 결합수 4개
c)는 삼중결합 1개, 단일결합 1개 = 총 결합수 4개
이렇게 탄소 원자는 최대 삼중결합까지만 가능합니다.
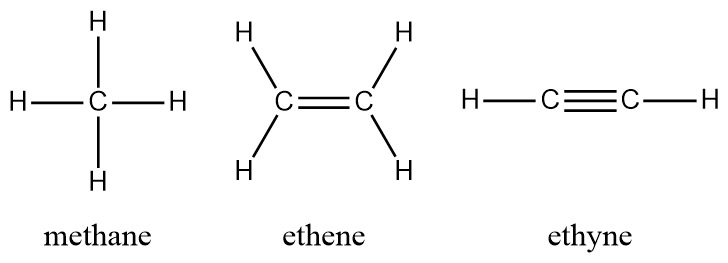
a) methane
> 탄소 원자 1개에 결합되어있는 다른 원자의 개수 = 4개
> 총 결합 선의 개수 = 4개
b) ethene
> 탄소 원자 1개에 결합되어있는 다른 원자의 개수 = 3개
> 총 결합 선의 개수 = 4개
c) ethyne
> 탄소 원자 1개에 결합되어있는 다른 원자의 개수 = 2개
> 총 결합 선의 개수 = 4개
탄소 원자 1개는
탄소 원자를 포함해서 다른 원자와
최대 4개, 최소 2개까지 결합할 수 있다.
[참고] 사중결합 이상의 결합을 형성하려면, 원자는 d 오비탈을 갖고 있어야 합니다.
즉, d 오비탈을 결합에 이용할 수 있는 원자는 사중결합, 오중결합도 가능합니다.

[ 그림 출처 Wikipedia ] dimolybdenum quintuple bond synthesis.
[ 관련 글 https://ywpop.tistory.com/10843 ]
탄소는 왜 C2 분자를 형성하지 못할까?
탄소는 왜 2원자분자를 형성하지 못할까?
[ 관련 글 https://ywpop.tistory.com/15010 ]
1개 탄소는 최대로 4개 원자와 결합할 수 있다
[키워드] 탄소 원자의 결합 기준, 탄소 원자를 포함해서 다른 원자와 최대 4개까지 결합, 사중 결합 기준, 4중 결합 기준, 사중 결합 사전, 4중 결합 사전, 탄소의 결합 기준, 탄소는 최대 4개 기준, 탄소 원자는 최대 4개 기준, 탄소는 4개 기준, 탄소 원자는 4개 기준, 탄소는 최대 4개 사전, 탄소 원자는 최대 4개 사전, 탄소는 4개 사전, 탄소 원자는 4개 사전, 탄소의 최대 결합 수 기준, 탄소의 최대 결합 개수 기준, 탄소의 최대 결합 수 사전, 탄소의 최대 결합 개수 사전
'화학' 카테고리의 다른 글
| 에너지와 파장 (0) | 2017.04.10 |
|---|---|
| 침전반응. 염화나트륨과 질산나트륨의 정성분석 (1) | 2017.04.10 |
| 파장을 진동수로. 6,562 Å (0) | 2017.04.09 |
| 화학량론. Li2O + H2O → 2LiOH (0) | 2017.04.09 |
| 단위환산. 수소 원자의 질량을 개수로 (0) | 2017.04.08 |
| 알짜이온반응식. CaCO3 + HCl (0) | 2017.04.08 |
| 0.2 N 탄산칼슘 용액 300 mL 만들기 (0) | 2017.04.08 |
| The combustion of hydrazine, N2H4, with oxygen (1) | 2017.04.08 |

댓글