약산-약염기의 염 용액의 pH. 0.200 M NH4F 용액의 pH
Calculate [H^+] in 1.0 L of a solution that contains 0.200 M NH4F.
For HF, Ka=7.2×10^-4 and for NH3, Kb=1.8×10^-5.
a) 6.3×10^-7 M
b) 0.200 M
c) 5.6×10^-6 M
d) 2.1×10^-8 M
e) 5.6×10^-10 M
---------------------------------------------------
▶ 참고: 약산-약염기의 염 용액의 pH
[ https://ywpop.tistory.com/4233 ]
---------------------------------------------------
pKa = -log(7.2×10^-4) = 3.143
pKb = -log(1.8×10^-5) = 4.745
pH = 1/2 (pKw + pKa – pKb)
= 1/2 (14 + 3.143 – 4.745)
= 6.2
pH = -log[H^+] = 6.2
[H^+] = 10^-6.2 = 6.31×10^–7 M
---------------------------------------------------
NH4^+(aq) + H2O(l) ⇌ NH3(aq) + H3O^+(aq)
Kh = Ka = Kw / Kb = (10^-14) / (1.8×10^-5) = 5.6×10^–10
Kh = x2 / 0.200-x = 5.6×10^–10
0.200-x ≒ 0.200 으로 근사하면,
x = [(5.6×10^–10)(0.200)]^(1/2) = 1.1×10^–5 = [H^+]
F^-(aq) + H2O(l) ⇌ HF(aq) + OH^-(aq)
Kh = Kb = Kw / Ka = (10^-14) / (7.2×10^-4) = 1.4×10^–11
Kh = x^2 / 0.200-x = 1.4×10^–11
0.200-x ≒ 0.200 으로 근사하면,
x = [(1.4×10^–11)(0.200)]^(1/2) = 1.7×10^–6 = [OH^-]
([H^+] = 1.1×10^–5) > ([OH^-] = 1.7×10^–6) 이므로,
H^+(aq) + OH^-(aq) → H2O(l) 반응 후 남아있는 [H^+]를 구하면
[H^+] = (1.2×10^–5) – (1.9×10^–6) = 1.0×10^–5 M
[ 관련 글 https://ywpop.tistory.com/4230 ]
'화학' 카테고리의 다른 글
| 12% 시약으로 0.4 ppm 용액 만들기 (0) | 2015.11.12 |
|---|---|
| 35% 염산(HCl) 용액으로 2% 염산 용액 200 mL 만드는 방법 (0) | 2015.11.12 |
| 2 M 암모니아수 50 mL 만드는 방법 (2) | 2015.11.12 |
| 산-염기 정의, 종류, 구분과 관련된 문제 (3) | 2015.11.11 |
| 기준 원자량의 변경. 탄소 대신 수소일 경우 (1) | 2015.11.11 |
| 산의 세기 비교. HI H2Te (1) | 2015.11.11 |
| 산화-환원 반응 완성하기: IO3- + I- → I3- (0) | 2015.11.10 |
| mmol/kg to mg/g, mg/g to mmol/kg (1) | 2015.11.10 |
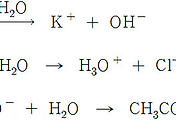
댓글