몰농도(M)와 노르말농도(N)의 관계식. 당량수
몰농도(M)와 노르말농도(N)의 관계식은 다음과 같습니다.

몰농도 × 당량수 = 노르말농도
M × (eq/mol) = N
(mol/L) × (eq/mol) = eq/L

※ 참고: 노르말농도 = 규정농도 = 당량농도 = normality
용액의 몰농도 개념은 매우 단순하기 때문에 구하기도 쉽습니다.
너무나 쉽게도 “용질의 mol수를 구해, 용액의 L수로 나눠주면” 끝입니다.
( 참고 https://ywpop.tistory.com/3222 )
그러나 노르말농도는 몰농도만큼 단순하지 않습니다.
( 노르말농도의 정의 https://ywpop.tistory.com/6131 )
양이온의 전하(산화수) 값을 구할 줄 알아야하고,
물에서 어떻게 이온화되는지도 알아야 합니다.
특히 산화제(환원제)일 경우에는 반응이 다르면 노르말농도도 달라집니다.
( KMnO4의 당량수 https://ywpop.tistory.com/3795 )
이 때문에 반응식을 이해해야만 산화제(환원제)의 노르말농도를 구할 수 있습니다.
다행히 산화제(환원제)를 제외한 물질의 노르말농도는
반응식을 보지 않고 물질의 화학식만으로도 노르말농도를 구할 수 있습니다.
보다 옳은 표현은, 물질의 화학식만으로도 물질의 당량수를 구할 수 있습니다.
물질의 당량수를 구할 수 있으면, 몰농도를 구해서,
위에 설명한 관계식으로부터 노르말농도를 구할 수 있습니다.
[당량수 구하는 방법]
- 당량수의 단위는 eq/mol
( 당량의 정의 https://ywpop.tistory.com/5411 )
1) 원자 및 이온의 당량수 = 원자가(하전수)
( 원자가 https://ywpop.tistory.com/6797 )
( 하전수 https://ywpop.tistory.com/6798 )
ex) Ag의 당량수 = 1 eq/mol
ex) Na의 당량수 = 1 eq/mol
ex) Ba의 당량수 = 2 eq/mol
ex) Ca의 당량수 = 2 eq/mol
ex) Al의 당량수 = 3 eq/mol
ex) Ag^+의 당량수 = 1 eq/mol
ex) Na^+의 당량수 = 1 eq/mol
ex) Ba^2+의 당량수 = 2 eq/mol
ex) Ca^2+의 당량수 = 2 eq/mol
ex) Al^3+의 당량수 = 3 eq/mol
ex) NH4^+의 당량수 = 1 eq/mol
ex) HCO3^-의 당량수 = 1 eq/mol
ex) H2PO4^-의 당량수 = 1 eq/mol [ 예제 ]
ex) SO4^2-의 당량수 = 2 eq/mol
ex) CO3^2-의 당량수 = 2 eq/mol
ex) PO4^3-의 당량수 = 3 eq/mol
2) 원소의 g당량수 = 원자량 / 원자가
ex) I2의 g당량수 = 126.90 / 1 = 126.90 g/eq
( 아래에 나오는 표 참고 )
---> I2의 당량수 = 2 eq/mol
( 관련 글 https://ywpop.tistory.com/8819 )
3) 분자(화합물)의 당량수 = 양이온의 전하수(하전수) 또는 “전하×개수”
ex) AgNO3의 당량수 = 1 eq/mol
ex) KNO3의 당량수 = 1 eq/mol
ex) NaCl의 당량수 = 1 eq/mol
ex) Na2CO3의 당량수 = 2 eq/mol [ 예제 ]
ex) BaCl2의 당량수 = 2 eq/mol
ex) CaCl2의 당량수 = 2 eq/mol
ex) CaCO3의 당량수 = 2 eq/mol
ex) CaO의 당량수 = 2 eq/mol
ex) CuSO4의 당량수 = 2 eq/mol
ex) FeSO4의 당량수 = 2 eq/mol [ 예제 ]
ex) AlCl3의 당량수 = 3 eq/mol
ex) Al2O3의 당량수 = 6 eq/mol ... (+3)×2=6
ex) Mg3(PO4)2의 당량수 = 6 eq/mol ... (+2)×3=6
( 관련 자료 www.suezwatertechnologies.com )
4) 산의 당량수 = 이온화되면 내놓는 H^+ 이온의 개수
( 산의 이온화식 https://ywpop.tistory.com/10061 )
( 산-염기의 노르말농도 https://ywpop.tistory.com/3093 )
ex) HClO4의 당량수 = 1 eq/mol
ex) HCl의 당량수 = 1 eq/mol
ex) HNO3의 당량수 = 1 eq/mol
ex) H2C2O4의 당량수 = 2 eq/mol
ex) H2CO3의 당량수 = 2 eq/mol
ex) H2SO3의 당량수 = 2 eq/mol
ex) H2SO4의 당량수 = 2 eq/mol
ex) H3PO4의 당량수 = 3 eq/mol
ex) H3BO3의 당량수 = 3 eq/mol
※ 산의 짝염의 당량수 = 산의 당량수
ex) NaNO3의 당량수 = 1 eq/mol
ex) Na2C2O4의 당량수 = 2 eq/mol
ex) Na2SO3의 당량수 = 2 eq/mol
ex) Na2SO4의 당량수 = 2 eq/mol
ex) Na3PO4의 당량수 = 3 eq/mol
5) 염기의 당량수 = 이온화되면 내놓는 OH^- 이온의 개수
ex) NaOH의 당량수 = 1 eq/mol
ex) KOH의 당량수 = 1 eq/mol
ex) NH3의 당량수 = 1 eq/mol
ex) Ca(OH)2의 당량수 = 2 eq/mol
ex) Ba(OH)2의 당량수 = 2 eq/mol
6) 산화제(환원제)의 당량수 = 산화제(환원제) 1 mol당 주고받은 전자의 개수
또는 산화-환원 반응에서 전자(e^-) 1 mol과 반응하는 양
ex) Na2S2O3의 당량수 [ 예제 ]
ex) K2Cr2O7의 당량수 [ 예제 ]
ex) KMnO4의 당량수 [ 예제 ]
[ 관련 예제 https://ywpop.tistory.com/4152 ] 산화제-환원제의 당량수. g당량수 구하기
따라서 만약 H2SO4 용액의 몰농도가 0.2 M이면, 이 용액의 노르말농도는
[ 0.2 M × 2 = 0.4 N ]이 됩니다.
▶ 당량 단위: eq
▶ 당량수 단위: eq/mol
▶ g당량(=1그램당량) 단위: g
▶ g당량수(= 당량무게, equivalent weight) 단위: g/eq
( 관련 글 https://ywpop.tistory.com/5945 )
▶ g당량수 = 몰질량 / 당량수
= (g/mol) / (eq/mol) = g/eq
[ 당량수 계산 예제 https://ywpop.tistory.com/4093 ]
[참고] 몰농도와 노르말농도의 차이. 노르말농도의 장단점
몰농도는 계산하기 쉽고(간단하고), 노르말농도는 계산하기 어렵다(복잡하다).
노르말농도를 계산하려면, 복잡한 당량의 개념을 알아야하고,
무엇보다 산화제, 환원제의 노르말농도는 반응마다 다르다.
( 관련 글 https://ywpop.tistory.com/3795 )
몰농도로 화학량론적 계산을 할 때는 균형 맞춘 화학 반응식이 필요하지만,
노르말농도로 화학량론적 계산을 할 때는 균형 맞춘 화학 반응식이 필요 없다.
( 관련 예제 https://ywpop.tistory.com/9090 )
▶ Equivalent weight of a salt = molar mass / total valency of cation
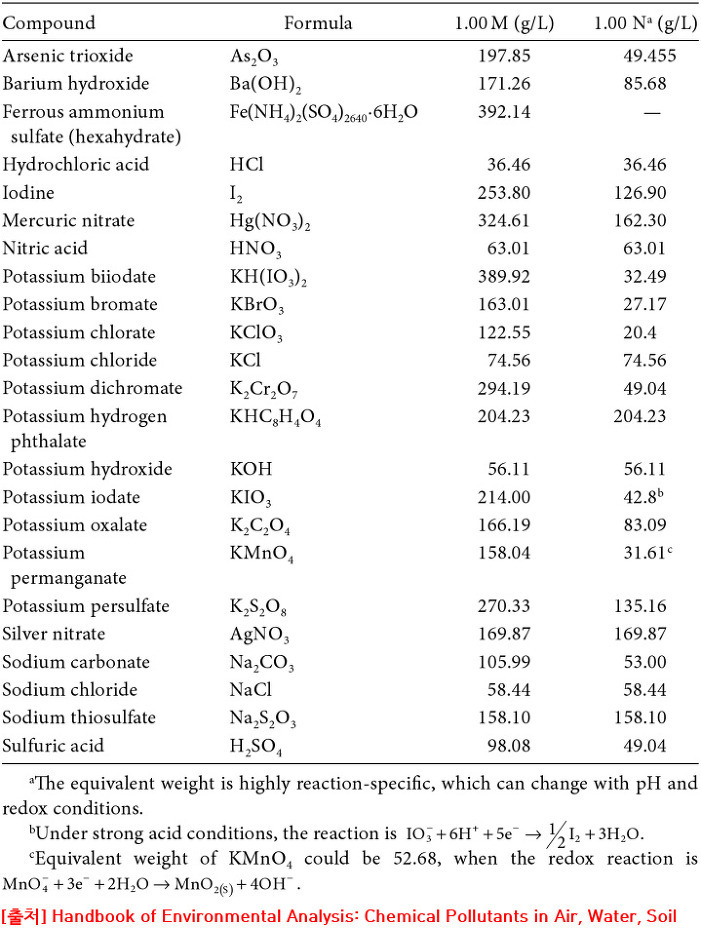
[표] 몇 가지 화합물의 몰농도 vs. 노르말농도
> 1.00 M 용액 1 L 또는 1.00 N 용액 1 L 제조에 필요한 시약의 질량(g)
예) 1.00 N Ba(OH)2 용액 1 L 제조에 필요한 Ba(OH)2의 질량을 계산하면,
Ba(OH)2의 당량수 = 2 eq/mol 이고,
Ba(OH)2의 몰질량 = 171.34 g/mol 이므로,
(1.00 eq/L) (1 mol / 2 eq) (171.34 g / 1 mol) (1 L)
= (1.00) (1 / 2) (171.34) (1)
= 85.67 g
> 표에서 1.00 N (g/L) 제목 아래 숫자는 각 시약의 ‘g당량’ 값과 같다.
예) Ba(OH)2의 g당량수 = (171.34 g/mol) / (2 eq/mol) = 85.67 g/eq
[ 관련 글 https://ywpop.tistory.com/20945 ] [표] 이온 및 화합물의 당량수
[키워드] 당량수 기준, 당량 기준, 당량수 구하기 기준, 당량 구하기 기준, 몰농도와 노르말농도의 관계식, 당량수의 정의 기준, 당량수의 개념 기준, 당량수 사전, 당량수 경전

[Google 검색 실적] Medal of Honor
'화학' 카테고리의 다른 글
| 이상기체방정식의 응용. 미지 시료 기체의 몰질량 계산 (0) | 2015.10.24 |
|---|---|
| 화학량론. 탄화수소 기체의 연소반응 (0) | 2015.10.24 |
| CH3COOH 완충용액의 pH. 헨더슨-하셀바흐 방정식 (0) | 2015.10.24 |
| 비열과 열용량. 얼음과 물의 혼합 (0) | 2015.10.24 |
| 이상기체방정식의 응용. PV / T = P’V’ / T’ (0) | 2015.10.23 |
| 원자와 이온의 크기 비교. 등전자성 이온 (0) | 2015.10.23 |
| 수소 이온의 농도가 10배 수준으로 바뀌면 pH는 한 단위 바뀌는 이유 (0) | 2015.10.23 |
| 아스피린(C9H8O4) 용액의 끓는점오름. 총괄성 (0) | 2015.10.23 |
댓글