280 K에서 이산화탄소의 상평형도
280 K에서 이산화탄소가 기체, 액체, 고체의
세 개의 다른 상이 될 수 있다.
각 상의 압력 범위를 나타내라.
[참고] 상평형도 1. phase diagram
[ https://ywpop.tistory.com/2600 ]
[참고] 상평형도 2. phase diagram
[ https://ywpop.tistory.com/2602 ]
아마 문제가 나온 교재 본문에
이산화탄소의 상평형도가 나올 겁니다.
이산화탄소의 상평형도에서
아마 x축이 온도 축일텐데,
x축에서 280 K (= 7℃) 지점을 찾아서
y축과 평행한 직선을 그립니다.
( 아래 그림 참고 )
그러면,
첫 번째로 만나는 곡선이 기체-액체 평형 곡선인데,
그 지점에서 이번에는 x축과 평행한 직선을 그립니다.
이때 y축과 만나는 지점이 있을텐데, (아래 그림에서 ①번 지점)
그 지점까지의 압력이 기체 상의 압력 범위가 됩니다.
그 다음,
두 번째로 만나는 곡선이 액체-고체 평형 곡선인데,
그 지점에서 이번에도 x축과 평행한 직선을 그립니다.
이때 y축과 만나는 지점이 있을텐데, (아래 그림에서 ②번 지점)
①번과 ②번 지점의 압력이 액체 상의 압력 범위가 됩니다.
끝으로,
②번 지점 이상의 압력이 고체 상의 압력 범위가 됩니다.
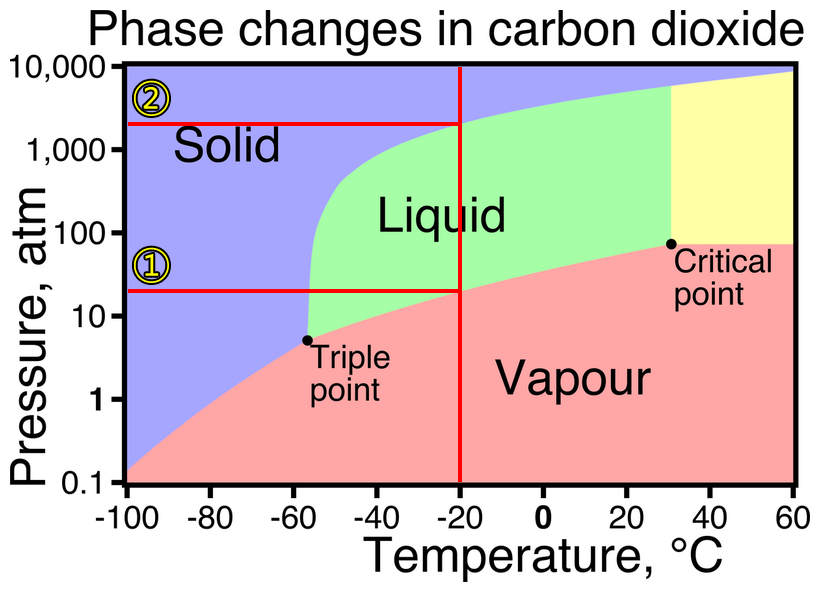
[그림] 253 K (= –20℃) 에서
이산화탄소의 각 상의 압력 범위를 나타낸 상평형도.
[키워드] 이산화탄소의 상평형도 기준, CO2의 상평형도 기준
'일반화학 > [11장] 액체와 분자간의 힘' 카테고리의 다른 글
| Which compound more volatile at 25℃, CCl4 or CBr4 (0) | 2024.06.17 |
|---|---|
| hexane bp 69.0℃ vaporization 25℃ 60℃ vapor pressure Trouton rule (3) | 2024.05.28 |
| [목차] 분자간 힘. blogspot (6) | 2024.05.05 |
| 분자간 힘. Ar HCl HF CaCl2 CH4 (0) | 2024.04.23 |
| 분산력은 표면적에 비례 (2) | 2024.03.16 |
| 분자간 힘의 종류. LiF CH4 SO2 (15) | 2023.09.08 |
| 끓는점은 분자 간 상호작용과 깊은 관계. RbCl, NH3, NO, Ne (3) | 2023.08.15 |
| 클라우지우스-클라페이롱 식. 300℃에서 물의 증기압 (5) | 2023.07.31 |

댓글