C4H5N 루이스 구조. σ 결합과 π 결합. 전자영역과 혼성화
Consider the molecule C4H5N,
which has the connectivity shown below.
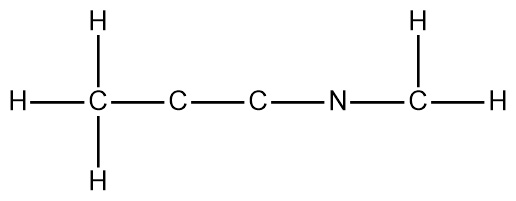
a) After the Lewis structure for the molecule is completed,
how many σ and how many π bonds are there in this molecule?
b) How many atoms in the molecule exhibit
i) sp hybridization,
ii) sp2 hybridization, and
iii) sp3 hybridization?
루이스 구조를 그릴 때는
탄소(C)는 결합 선이 4개,
질소(N)는 결합 선이 3개,
수소(H)는 결합 선이 1개가 되도록 그린다.
( 참고: 결합 선 https://ywpop.tistory.com/2872 )

[주의] 질소는 옥텟 규칙을 만족시키기 위해
비공유 전자쌍 1개를 그려준다.
> 단일결합 = 1개의 σ 결합
> 다중결합 = 1개의 σ 결합 + 나머지는 π 결합
( 참고 https://ywpop.tistory.com/4805 )
> σ 결합의 개수 = 9개
> π 결합의 개수 = 3개
> 전자 영역의 개수 = 4 ---> sp3 혼성
> 전자 영역의 개수 = 3 ---> sp2 혼성
> 전자 영역의 개수 = 2 ---> sp 혼성
( 참고 https://ywpop.tistory.com/11542 )
( 참고: 수소는 비혼성 오비탈이므로, 제외. )
i) sp hybridization: 2개
ii) sp2 hybridization: 2개
iii) sp3 hybridization: 1개
순서대로,
C – C ≡ C – N: = C
sp3 – sp – sp – sp2 – sp2
[ 관련 글 https://ywpop.tistory.com/470843 ]
아크릴로니트릴 분자의 결합. H2C=CHC≡N 시그마 결합 파이 결합
[키워드] 단일결합과 다중결합 기준, 시그마결합과 파이결합 기준, 전자영역과 혼성화 기준, 전자영역과 혼성오비탈 기준, C4H5N 루이스 구조 기준, C4H5N 루이스 기준, 시그마 결합 파이 결합 기준, 시그마 결합 기준
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 이온결합 화합물과 옥텟규칙. NaCl octet rule (5) | 2023.06.29 |
|---|---|
| 이온 결합의 결합비로 화학식 완성하기 (1) | 2023.06.28 |
| AC2 CD2 BD3 분자. C N O F 중 하나 (5) | 2023.06.25 |
| RnCl2 루이스 구조 그리기 (0) | 2023.06.14 |
| 결합에너지로 반응엔탈피 계산. HCN + 2H2 → CH3NH2 (0) | 2023.06.13 |
| KF의 격자에너지. KF(s)의 생성 에너지 계산 (0) | 2023.06.13 |
| 형식전하의 대표적 예외. 형식전하와 전기음성도 (4) | 2023.06.11 |
| 형식전하 계산. SO2 N2H4 O3 (3) | 2023.06.04 |


댓글