728x170
반응 진행 그래프로 두 반응 비교
▶ A 반응
> 반응물의 에너지 준위: 50 kJ/mol
> 생성물의 에너지 준위: 40 kJ/mol
> 활성화 에너지의 에너지 준위: 70 kJ/mol
▶ B 반응
> 반응물의 에너지 준위: 50 kJ/mol
> 생성물의 에너지 준위: 20 kJ/mol
> 활성화 에너지의 에너지 준위: 80 kJ/mol
---------------------------------------------------
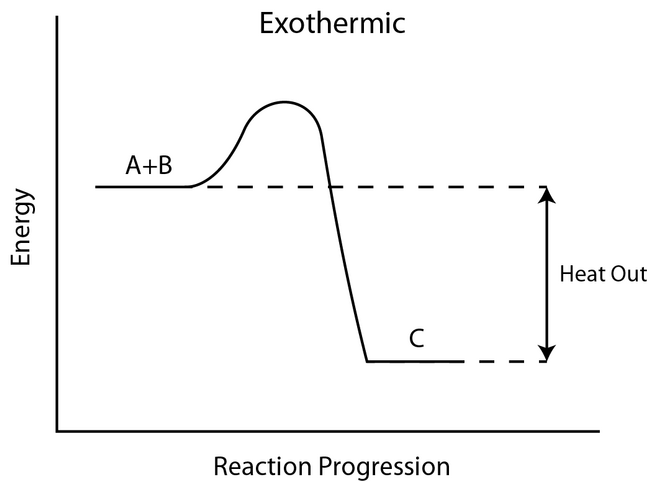
[ 그림 출처 commons.wikimedia.org ] 발열 과정. 발열 반응.
[1] 각 반응의 알짜 에너지 변화
ΔH = 반응물의 에너지 준위와 생성물의 에너지 준위 차이
> A 반응: 10 kJ/mol 또는 ΔH = –10 kJ/mol
> B 반응: 30 kJ/mol 또는 ΔH = –30 kJ/mol
( –부호는 발열 반응임을 의미. )
[2] 어느 쪽이 더 발열적인가?
> ΔH 값이 더 큰 B쪽이 더 발열적이다.
[3] 농도와 온도가 동일할 때,
어느 쪽 반응이 더 빨리 일어날까?
> 반응물의 에너지 준위와
활성화 에너지의 에너지 준위 차이가 더 작은
즉, 활성화 에너지가 더 작은
A가 더 빨리 일어난다.
( 참고 https://ywpop.tistory.com/15 )
반응형
그리드형(광고전용)
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 30℃ 물 150 g을 350℃ 수증기로 (kcal) (0) | 2022.09.13 |
|---|---|
| 0.5 kg 물의 온도를 15℃에서 35℃까지 높이는데 필요한 열량 (2) | 2022.08.27 |
| ΔH 계산. CO(g) + 1/2 O2(g) → CO2(g) (0) | 2022.08.20 |
| 열기관의 열효율. efficiency of a heat engine (0) | 2022.08.02 |
| 25℃ H2O(l) 1 g의 기화열 (0) | 2022.07.03 |
| 25℃ 물의 기화열. heat of vaporization of water (0) | 2022.07.03 |
| 100℃ 수증기 10 g을 50℃ 물로 만들 때 방출되는 열 (cal) (0) | 2022.06.29 |
| 1.00 M NaCl 10.0 mL + 1.00 M AgNO3 10.0 mL AgCl 25.0℃ 32.6℃ (0) | 2022.06.27 |


댓글