PO4^3- 루이스 구조 그리기. Lewis structure of PO4^3-
---------------------------------------------------
▶ 참고: 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
(P) + 4(O) + 3 = (5) + 4(6) + 3 = 32
[2단계] 화합물의 기본 골격 구조를 그린다.

32 – 4(2) = 24
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )

24 – 4(6) = 0
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
> 남아있는 전자도 없고, 중심 원자도 팔전자 규칙을 만족한다.
> 더 안정한 루이스 구조가 가능한지 알아보기 위해,
각 원자의 형식 전하를 계산해보자.
▶ 형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
> P의 형식전하 = 5 – 0 – (8/2) = +1
> O의 형식전자 = 6 – 6 – (2/2) = –1
---> 5개 원자 모두 형식전하를 갖고 있다.
---> 이때 형식전하의 합 = –3 = 이온전하
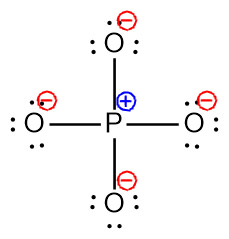
P는 3주기 원소이므로, 비어있는 d 오비탈을 갖고 있다.
① 중심 원자가 3주기 이상의 원자이고, and,
② 형식전하를 없앨 수 있다면,
---> 팔전자 (옥텟규칙) 를 초과할 수 있다.
---> 확장 팔전자 규칙 또는 18전자 규칙
( 참고: 18전자 규칙 https://ywpop.tistory.com/3752 )
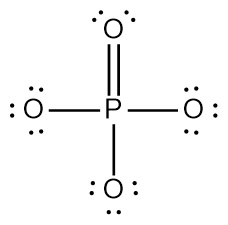
> P의 형식전하 = 5 – 0 – (10/2) = 0
> 이중결합 O의 형식전자 = 6 – 4 – (4/2) = 0
---> 3개 원자만 형식전하를 갖고 있다.
---> 이때 형식전하의 합 = –3 = 이온전하
---> 형식전하를 갖는 원자의 개수가 더 작은
두 번째 구조가 더 안정한 루이스 구조이다.

[그림] 가장 안정한 PO4^3-의 루이스 구조.
이중결합은 4개 O에 모두 가능하므로,
PO4^3- 이온은 4개의 공명 구조를 갖는다.
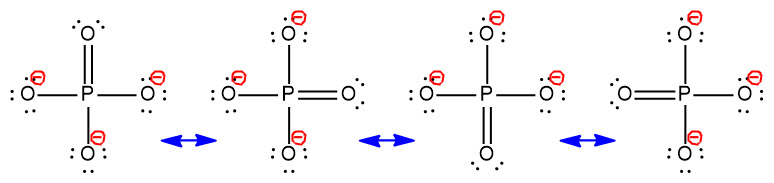
[그림] Resonance structures for PO4^3- (phosphate ion).
두 번째 구조는 형식 전하를 비교해도 더 안정하고,
게다가 공명 구조를 갖기 때문에, 더욱더 안정하다.
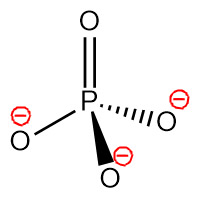
[그림] PO4^3-의 기하 구조.
중심 원자 P의 전자 영역 = 4개 이므로,
> P의 혼성 오비탈 = sp^3
> 이온의 기하 구조 = 사면체
( 참고 https://ywpop.tistory.com/11542 )
[키워드] PO4^3- 루이스 기준문서, 인산 이온의 루이스 구조, PO4^3- (phosphate ion) resonance structures
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| SO2F2의 루이스 구조와 형식전하 (0) | 2021.11.19 |
|---|---|
| F3NO의 형식전하 (0) | 2021.11.19 |
| HClO2의 형식전하 (0) | 2021.11.19 |
| 에틸렌, C2H4 루이스 구조 그리기 (0) | 2021.11.15 |
| CH3–N=C=O. isocyanatomethane의 기하구조 (1) | 2021.10.29 |
| C2H2 루이스 구조 그리기 (1) | 2021.10.06 |
| COF2의 루이스 구조 (0) | 2021.08.17 |
| CH3^+ 루이스 구조 그리기. Lewis structure of CH3^+ (2) | 2021.08.08 |




댓글