–20.0℃ 얼음 0.500 kg을 250.0℃ 수증기로 (kJ)
–20.0℃ 얼음 0.500 kg을 250.0℃ 증기로 전환에 필요한 에너지는?
열용량은 다음과 같다.
▶ 얼음의 비열 = 2.03 J/g•℃
▶ 물의 비열 = 4.18 J/g•℃
▶ 수증기의 비열 = 2.02 J/g•℃
▶ 얼음의 융해 잠열, ΔH_용융
= 6.02 kJ/mol / (18.015 g/mol) = 0.334166 kJ/g = 334.166 J/g
▶ 물의 증발 잠열, ΔH_증발
= 40.7 kJ/mol / (18.015 g/mol) = 2.25923 kJ/g = 2259.23 J/g
---------------------------------------------------
[참고] 열용량과 비열
[ https://ywpop.tistory.com/2897 ]
[참고] 현열과 잠열
[ https://ywpop.tistory.com/19273 ]
---------------------------------------------------
1) –20.0℃ 얼음을 0℃ 얼음으로 바꾸는데 필요한 열
q = C m Δt
= (2.03 J/g•℃) (500 g) (20 ℃)
= 20300 J
2) 0℃ 얼음을 0℃ 물로 바꾸는데 필요한 열
q = C m
= (334.166 J/g) (500 g)
= 167083 J
3) 0℃ 물을 100℃ 물로 바꾸는데 필요한 열
q = C m Δt
= (4.18 J/g•℃) (500 g) (100 ℃)
= 209000 J
4) 100℃ 물을 100℃ 수증기로 바꾸는데 필요한 열
q = C m
= (2259.23 J/g) (500 g)
= 1129615 J
5) 100℃ 수증기를 250℃ 수증기로 바꾸는데 필요한 열
q = C m Δt
= (2.02 J/g•℃) (500 g) (150 ℃)
= 151500 J
1) + 2) + 3) + 4) + 5)
= 20300 + 167083 + 209000 + 1129615 + 151500
= 1677498 J
= 1677.498 kJ
답: 1680 kJ
[ 동일 예제 https://ywpop.tistory.com/9428 ]
[ 관련 예제 https://ywpop.tistory.com/18427 ] –12℃ 얼음 27.9 g이 115℃ 수증기로 변할 때 엔트로피 변화
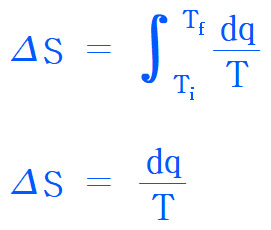
[ 관련 글 https://ywpop.blogspot.com/2024/08/110-0-1-kg-110.html ]
물의 비열 1, 수증기의 비열 0.45, 100℃에서의 증발 잠열이 539㎉/㎏일 때 110℃ 수증기의 엔탈피는? (단, 기준 상태는 0℃, 1atm의 물이며 비열의 단위는 ㎉/㎏·℃이다.)
물의 비열 1, 수증기의 비열 0.45, 100℃에서의 증발 잠열이 539 kcal/kg일 때 110℃ 수증기의 엔탈피는? (단, 기준 상태는 0℃, 1 atm의 물이며 비열의 단위는 kcal/kg•℃이다.)
[ 관련 글 https://ywpop.blogspot.com/2024/08/5-5-g-110-cal.html ]
–5℃ 얼음 5 g을 110℃ 수증기로 (cal)
[키워드] 얼음을 수증기로 기준, 얼음을 수증기로 사전, 상변화 시 엔트로피 변화 기준, 상변화 시 ΔS 기준
'일반화학 > [05장] 열화학' 카테고리의 다른 글
| 8.00 g Ba(s) 100.00 g water 22.00℃ 77.62℃ 4.18 ΔH (0) | 2021.10.19 |
|---|---|
| 57.0 mL 0.100 M AgNO3 57.0 mL 0.100 M HCl 22.96℃ 23.76℃ 114.0 g (0) | 2021.10.18 |
| 135 g metal sample 19.5℃ 100.0℃ 2.50 kJ (0) | 2021.10.17 |
| –5℃ 얼음 10 g을 16℃ 물로 만드는데 필요한 열량 (cal) (0) | 2021.10.15 |
| 화학 에너지. chemical energy (0) | 2021.10.14 |
| 25℃ 물 10.0 g을 –10℃ 얼음으로 (몰열용량) (0) | 2021.10.09 |
| 물 8.0 g을 42.0℃에서 45.0℃로 가열하는데 필요한 에너지(cal) (0) | 2021.10.03 |
| 13 g alcohol from 11℃ to 23℃ 0.588 cal/g•℃ (1) | 2021.09.28 |

댓글